法规政策
-
2025.08.22
上海医疗器械博览会|部件(part)、组件(component)和附件(accessory)如何区分?
企业在申请MDR认证时,经常将产品的部件(part)、组件(component)和附件(accessory)概念混淆。

阅读更多 -
2025.08.20
上海医疗器械展览会|一文读懂:I 类 / II 类 510K 豁免医疗器械的美国 FDA 注册全流程
上海医疗器械展览会将通过表格与文字结合的方式,清晰梳理 510K 豁免的核心信息。

阅读更多 -
2025.08.04
中国医疗器械展|用于医疗器械灭菌的环氧乙烷(EtO)的监管状态
中国医疗器械展主要区分在制造商环节已完成环氧乙烷的灭菌监管,以及需要在医疗机构等场所利用EtO cartridges 对医疗器械进行重复灭菌的产品的监管。

阅读更多 -
2025.05.16
国际医疗器械展览会|第二类有源医疗器械注册全流程审评解析
近年来,第二类有源医疗器械的注册申报通过率持续承压,在首次注册、变更注册及延续注册申请中,不少产品因资料不全或不合规被要求补正。

阅读更多 -
上海医疗器械展|中国医疗器械企业全球化破局:为何“先取欧洲CE,再攻中国NMPA”?
为什么中国企业的三类医疗器械不先拿国内NMPA注册证,反而先去欧洲申请CE认证?

阅读更多 -
2025.04.01
上海医疗器械展|创新医疗器械的审批流程是怎样的?
上海医疗器械展带你了解创新医疗器械的审批流程。

阅读更多 -
2025.03.25
中国医疗器械博览会|FDA|一文读懂FDA医疗器械分类和注册途径选择
中国医疗器械博览会了解到,确定产品类别是启动医疗器械注册的第一步。了解FDA医疗器械的分类法规至关重要,不仅有助于制造商顺利将医疗器械产品引入美国市场,避免因分类错误导致的对注册时限、费用和资源的影响和损耗,以及可能面临的被扣货/拒绝入境/列入黑名单等风险,同时也有助于注册从业者学习和比较不同监管机构要求上的异同,拓展法规知识。
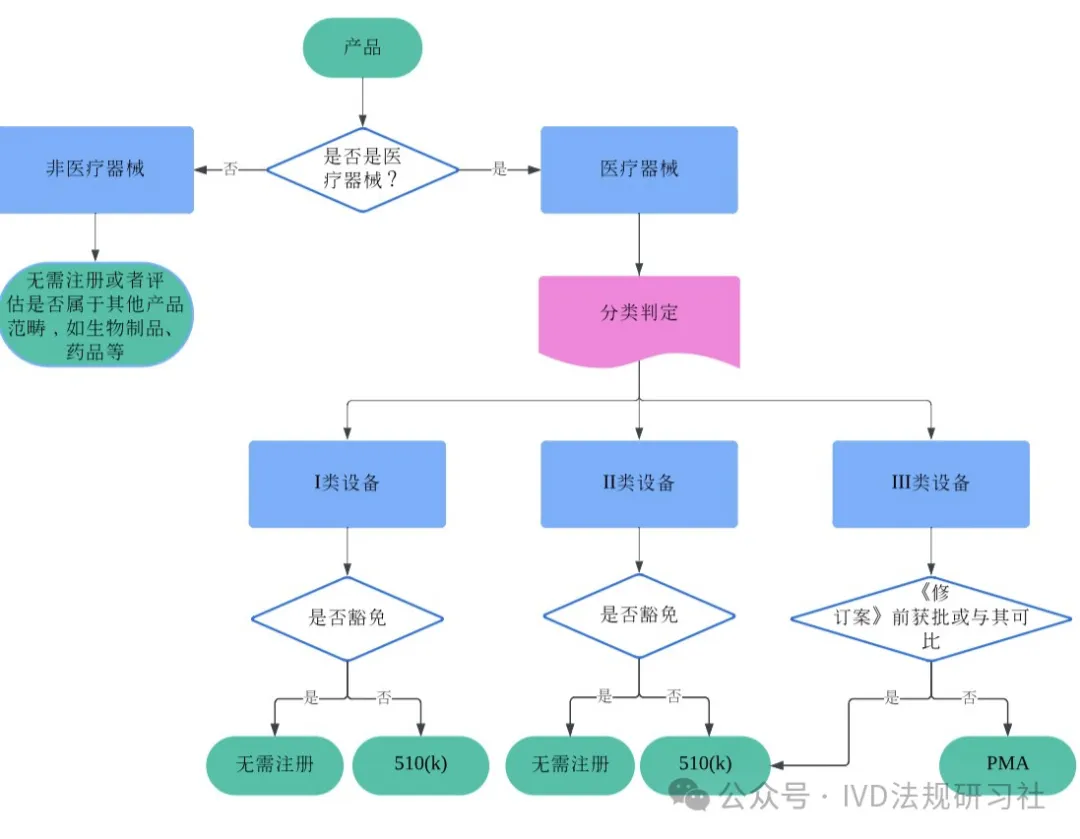
阅读更多 -
2025.02.26
上海医疗器械展会|人工智能医疗器械注册:新技术带来的新挑战
上海医疗器械展会了解到,近年来,人工智能(AI)技术在医疗器械领域的应用迅速发展。从影像诊断到手术机器人,再到智能健康管理设备,AI医疗器械正成为医疗智能化的关键驱动力。
阅读更多 -
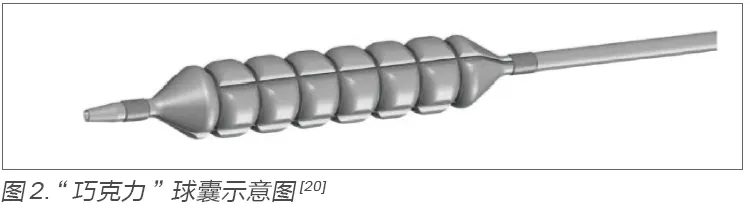
上海医疗器械展|【学术分享】血管内特殊球囊审评思考
上海医疗器械展了解到,血管内应用的球囊扩张导管一般由导管管体、球囊、不透射线标记、导管座等结构组成。普通球囊扩张血管时血管壁受力不均,导致血管内膜/ 斑块无序撕裂,用于中、重度冠状动脉钙化病变扩张成功率低而并发症发生率高,用于股浅动脉病变严重夹层(C-F型)发生率达42%、支架补救率达74.2%[1,2]。
阅读更多 -
2025.02.12
国际医疗器械展览会|FDA最新发布“人工智能设备指南草案”解读
2025年1月7日,美国食品药品监督管理局FDA发布了“针对人工智能医疗器械开发商的综合指导草案”指南——《人工智能设备软件功能:生命周期管理及上市提交建议草案》。

阅读更多











