上海医疗器械展心血管介入器械之药物洗脱支架—包括镁合金等材料及涂层研究进展
2022-07-21
据统计,我国目前冠心病患者人数已达1100万人,心肌梗死患者约为400万~500万人。经皮冠状动脉介入治疗(PCI)因其具备微创、省时、安全、高效等优势从而发展迅速,已成为治疗冠心病的主流方式。心脏支架主要用于冠心病的治疗,冠心病是由于冠状动脉粥样硬化使血管阻塞导致心肌缺血缺氧而引起的心脏病,又称“缺血性心脏病”。冠心病介入治疗(PCI)已经经历了三代技术发展:中继球囊扩张术、金属裸支架(BMS)和药物洗脱支架(DES)。目前世界范围内应用的支架大部分是第三代支架——药物洗脱支架(DES)。
然而,目前主流的永久金属冠脉支架因其不可降解,在植入人体后会伴随患者一生,且存在需终生服药、承担远期支架疲劳断裂风险、血管再狭窄和动脉粥样硬化发展二次干预受限等一系列问题。随着医学的不断发展,“介入无植入”的血管重建近年来已成为趋势,已发展出金属可吸收和聚乳酸高分子可吸收材料冠脉支架。
药物洗脱支架的发展进程
让我们先从冠脉介入发展史谈起。德国人Gruntzig(图一),1977年9月15日在瑞士苏黎士,局麻经股动脉穿刺,采用自制的球囊导管成功扩张了一例冠状动脉狭窄病变,开启血管内介入治疗的新时代。首例接受PCI治疗的勇士(图二)2007年一张照片,距离球囊扩张术的1977年已有30年岁月。
回顾40多年发展历史,一个个的里程碑事件推动PCI技术不断发展。1977年第一例经皮冠状动脉球囊扩张成形术成功,但仍会面临血管弹性回缩,急性闭塞负性重构,再狭窄发生率高达30%〜50%等问题;1986年金属裸支架诞生,虽然部分解决了单纯球囊扩张后面临的问题,但再狭窄发生率仍高达20%〜30%;直到2001年Morice和同事首次成功完成了药物洗脱支架随机试验,标志着药物洗脱支架的诞生。2003年以后是药物洗脱支架时代,再狭窄率降至5%〜10%[1]。
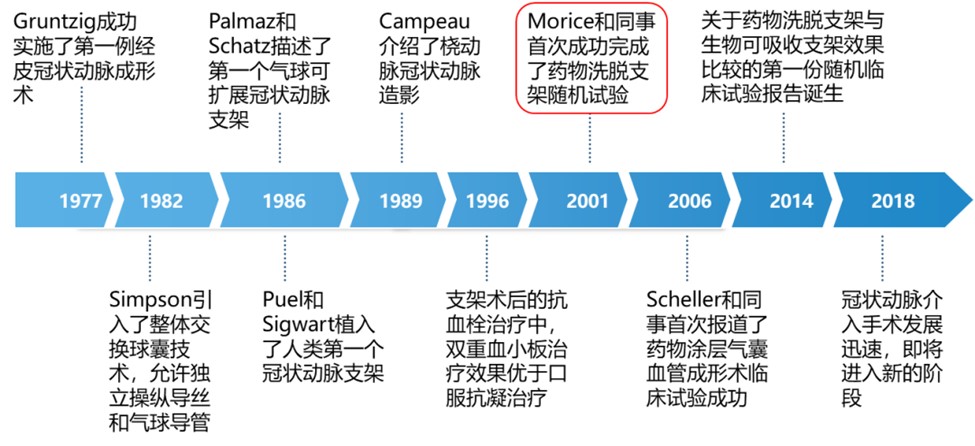
中国PCI年手术量从1984年至1987年总共仅有45例,进入二十世纪后手术量飞速增长,2018年全年冠心病介入例数为915256例,全球第一。其中药物洗脱支架的使用比例达99.6%,极大降低了血管再狭窄率[2]。 2006年在欧洲心脏病大会上的报道给了第一代药物洗脱支架沉重打击,746例患者长期随访发现,药物支架随着时间延长,死亡率可能比裸支架BMS要高,虽然统计学上无差异,但有趋势,这在行业内引发了巨大的冲击[3]。支架晚期血栓风险增加,可能与支架残留聚合物涂层导致的持续炎症反应、延迟的内皮化或伴随的器械异常有关。
药物洗脱支架(DES)结构
DES由三部分组成:1)支架固体骨架;2)聚合物涂层;3)抑制再狭窄药物。
1)支架固体骨架
DES支架采用孔槽式的环向结构并连同球囊一同植入,球囊膨胀致支架扩张,在扩张的过程中,支架应减少轴向的缩短,很好的适应血管的几何形状,并足以支撑病变血管,保证正常的血流量。因此,要求支架固体骨架具有一定的柔性、很好的延展性以及很强的径向支撑力。
支架应选用较为惰性的材料,例如不锈钢,或是铬钴合金等具有很好的扩张性能的合金。
美国FDA以及欧盟对支架疲劳寿命有着明确的要求:按统计学上合适数量的支架在临床相关环境下进行不少于3.8亿次脉动疲劳循环(约10年),测得疲劳数据并且支架不能发生失效。(有限元和疲劳加速测试完成)
(Happy hour:来来来,有限元了解一下,结构用线单元还是体单元?应力、应变怎么加?导致结构破坏的损伤是什么?断裂点在哪里?粘接元怎么加?破坏准则用哪个?血管的流体模型怎么做?血流的流场怎么加?加速疲劳试验怎么做?小样本试验结果的置信度有多高?如何对结构做优化分析?……)
支架平台的优化:
镍钛合金或钴铬合金等替代不锈钢材质,支架金属性能提升,合金密度更高,支架梁更薄,对血流的影响更小,更易内皮化;同时保证支架径向支撑力和抗疲劳性。
2)支架涂层
从球囊、支架到导管,优质医用表面处理供应商也将汇聚上海医疗器械展Medtec China。 将抑制再狭窄药物注入聚合物内,并将涂层置于支架金属表面。在药物释放的过程中,涂层起到载体的作用,将溶解在涂层内的药物通过扩散作用,逐渐释放到动脉壁内,达到治疗的作用。不同聚合物的组成加工工艺可以改变涂层药物释放的速度。
(血液、支架形状、动脉壁、药物特性、血栓、涂层等均会对药物释放产生影响,选取什么作为变量,采用什么样的优化方法,对药物释放进行优化。)
涂层优化:第二代药物洗脱支架要么用可降解涂层缩短在体内的存留时间,要么通过改进涂层生物相容性使其在体内长期安全存在。 3)抑制再狭窄药物
植入初期,由于支架的膨胀与动脉壁接触,引起内膜的损伤,会导致血管内斑块的产生以及淋巴细胞的聚集。这类细胞的增多会显著引起动脉壁内平滑肌细胞的增生、并朝向动脉内层迁移,进而引起管内再狭上,理想的抑制再狭窄药物应具有不阻碍血管细胞自我修复的特性并且要抑制平滑肌细胞向内增生。
除了以上技术资讯,上海医疗器械展Medtec China已经从2012年开始连续举办了7届植入介入医疗器械峰会,会议围绕骨科植入物、心血管介入产品,探讨其法规政策、市场趋势、研发与设计与材料创新等内容,为医疗器械制造商、材料供应商及服务商等提供国内外的经验借鉴。今年作为Medtec中国展同期“植入介入医疗器械峰会”的第八个年头,会议内容再次升级,高校、医院、企业的嘉宾讲从材料、临床需求、产品研发等多维度剖析植入介入现状及发展。点击快速预登记。
药物洗脱支架材料
随着医学的不断发展,“介入无植入”的血管重建近年来已成为趋势,已发展出金属可吸收和聚乳酸高分子可吸收材料冠脉支架。
聚乳酸通常用于医疗植入物,如溶解缝线。该材料及其共聚物通过水解反应逐渐降解,其终产物为水和二氧化碳,在可吸收性与生物相容性方面表现优异,成为目前生物可吸收支架当中应用最为广泛的材料。
虽然聚乳酸类生物可吸收支架显示了良好的前景,但材料本身依然具有局限性。针对冠脉支架的植入,首先聚乳酸韧性较差,在植入扩张回缩的过程当中经常发生破裂;其次聚乳酸降解时间长,通常需要三年以上的时间;再者聚乳酸适应症范围较窄,只能适用于直径较大的血管,并且降解时候会产生酸性副产物。此外,支架置入后并不是一劳永逸的过程。据临床试验的长期随访数据显示,随机试验和观察性研究表明支架仍有令人担忧的晚期血栓、再狭窄风险较高的信号。
此后,人们将目光聚焦在机械性更强、降解速度更快以及降解副产物更安全的金属材料上。可降解金属支架材料主要为镁合金、锌合金以及铁基合金三种。而铁基合金材料在抗拉强度以及密度等力学性能上优于前两者,由此成为业界公认的目前最有潜力的可降解金属支架材料。
镁合金最新技术进展

而在众多可吸收材料中,镁合金一度被称为“革命性金属材料”,它的功能性、生物相容性、稳定性、可加工性十分平衡。而可吸收镁合金支架植入人体后,可逐步降解,血管也随之逐渐恢复自然状态和生理功能,因异物引起的血管风险显著降低。此外,镁合金的力学性能与骨骼相似,显著高于聚乳酸,可设计、制造更薄的支架,促进内皮化。还可通过电抛光工艺对镁合金支架进行表面处理,减少对血流动力学的干扰。未来,可吸收镁合金支架有望在冠脉介入、外周介入、神经介入等多个领域中应用。研究表明可应用于心血管支架、骨固定材料、牙种植材料,并在人体内完全降解。
可吸收镁合金支架的研发制造面临三个重大挑战。分别是:降解速率快且难以控制;支架的有效支撑时间和降解时间上的平衡;力学性能上的强度、塑性难以平衡。只有解决这三性合一问题才能研发出临床认可的镁合金产品。
功夫不负有心人。联合研发团队历时数年研发攻关,进行了材料改性,加工工艺改进,突破了多个技术难点。
当前的支架技术基于使用由耐腐蚀金属制成的永久支架。然而,一旦血管愈合,就不再需要支架的脚手架功能,并且永久金属假体的存在带来了明显严重缺陷。另一种选择是由聚合物或金属制成的可生物吸收的支架。候选金属之一是镁合金,但是具有极低的延展性,这使得它们难以形成微型管(网状管状支架的前体)。另外,当网格通过气球膨胀时,它应具有足够的延展性,以避免网格支柱断裂。该技术使天然易碎的镁合金更具延展性。
联合研发团队成员、重庆大学副教授佘加在峰会现场发言:“支架从生产到使用的过程中,首先要将其压握到球囊上,术中由医生送到指定位置后,再通过给球囊加压将其撑开。在这一压一撑的过程中,支架的形变是相当大的,因此支架不仅要强度足够高,还要具有良好的塑性,受力应变之后不能发生断裂。目前专用于心血管支架的镁合金材料是非常稀缺的,工业镁合金的纯度低,无法满足医用要求。支架需要在微细管上进行雕刻,微细管的管壁薄到只有200微米,如果合金杂质含量高,在加工过程中就容易造成断裂,成品率非常低。在支架研发中,镁合金的强度、塑性和降解性能很难协同。植入体内后,如何控制镁合金支架的降解速度和降解的均匀性也是一大难点。” 为了解决镁合金的纯度问题,重庆大学研究团队通过镁合金熔体的无熔剂变温自纯化工艺,将镁合金中的Fe含量降至10ppm,纯度提高后,腐蚀速率大幅降低,耐蚀性显著改善,为高性能医用镁合金制备奠定重要基础。重庆大学研究团队还发展了连续锻造挤压技术,获得连续的累积变形,促进再结晶,实现镁合金材料锭坯的均匀化制备。
为了进一步控制支架在体内的降解速度,美中双和研发团队开发出支架复合涂层,能够更好地调整降解时间,保证支架在一定周期内的有效支撑。在有效控制降解速度的问题上,美中双和团队通过优化支架结构设计,有效分散支架应力,使其更适合镁合金的力学特性,并避免保护性涂层开裂。由于镁合金在X射线下的可视性很差,所以美中双和在支架的头端和尾端设置了双显影点,帮助医生在术中对支架进行准确的定位。
上海医疗器械展Medtec China中亮相的表面处理供应商,展品包括亲水超滑涂层,医疗器械功能涂层,射流式等离子处理设备,WS2二硫化钨、超声波球囊喷涂机等。
涂层技术
氟化物涂层技术
第二代药物洗脱支架中,国产支架大多是可降解药物涂层,而外资公司的主要研发方向以高生物相容性的永久涂层为主,如美敦力 Resolute(Biolink)、雅培 Xience(氟化物涂层)、波科 PromusElement(氟化物涂层)。作为中国唯一掌握了高生物相容性氟化物涂层专利技术的是信立泰公司,其子公司苏州桓晨Alpha支架和北京雅伦Maurora支架均应用了该氟化物涂层技术。

氟化物人造血管

氟化物人造瓣膜
氟化物涂层药物洗脱支架可以说是第二代药物洗脱支架金标准。高生物相容性永久涂层采用的氟化聚合物在植入医疗器械中广泛应用,如人工血管材料、氟化物人造瓣膜[6],不可吸收氟化聚合物缝线和补片[7],人工血管的氟化聚合物涂层等等[8]。
氟化物涂层具有良好的生物相容性,血栓、炎性反应发生率低。永久聚合物涂层可以起到隔绝金属与血液的作用;在绿色荧光染色下,各种可降解载体的药物洗脱支架血小板吸附情况较多,而氟化物涂层的药物洗脱支架血小板吸附情况最少,血栓发生风险最低;另外在电镜下观察炎症细胞的负荷量,同样氟化物涂层的药物洗脱支架是最少的,炎症反应发生率最低。炎性反应会影响到血管内皮愈合[9]。
新型涂层显著改善镁合金血管支架疗效:
目前报道的镁合金表面氧化钛涂层多为粗糙度极小且微观形貌不可控的涂层,而针对氧化钛涂层微纳米结构设计的研究报道较少。由于细胞在生物材料表面具有特异性吸附行为,若通过特殊工艺制备出具有一定表面粗糙度的微纳米结构氧化钛涂层,将有利于促进血管支架植入人体后的表面内皮化,从而改善支架对病变血管的疗效。基于以上考虑,利用溶剂热反应法在镁合金血管支架上合成了具有特殊微纳米结构的氧化钛涂层,研究了溶剂热反应条件对氧化钛涂层微纳米结构和涂层整体形貌的调控作用。
采用溶剂热法在镁合金血管支架表面制备了具有微纳米结构的锐钛矿氧化钛涂层,研究了溶剂热反应条件对涂层微观形貌的影响。结果表明,通过改变反应时间,HF含量,及反应溶液中氟离子浓度,可获得不同微纳米结构的氧化钛涂层。随着反应时间延长,锐钛矿晶体形貌由八面体向片层状转变且致密化;随着反应温度升高,片层微结构逐渐增多、片层的厚度逐渐减小;随着溶液中HF含量增加,片状氧化钛的分布逐渐稀疏,涂层化效率降低;随着F-离子浓度增加,片状氧化钛的排列形式趋于分散,由多片交叉叠加向单片演变。反应条件为160℃,10 h , 0.25 mL / HF(40 wt.%), 0.25 mL / NH4F(0.2 M)时,在镁合金血管支架表面制备出了均匀致密,呈片状规整排列的微纳米结构氧化钛涂层,表面粗糙度为350.7 nm。
总结:
(1) 针对生物医用镁合金面临的问题,选用无水乙醇作溶剂,在较低的反应温度下,通过溶剂热法在镁合金血管支架表面合成了锐钛矿氧化钛微纳米结构涂层。
(2) 通过改变溶剂热反应条件,可实现镁合金血管支架表面氧化钛涂层的微观形貌调控。反应时间、反应温度、氢氟酸含量及F-离子浓度的变化直接影响了涂层的致密度、表面粗糙度及微纳米结构的排列。
(3) 反应条件为160℃,10 h , 0.25 mL / HF(40 wt.%), 0.25 mL / NH4F(0.2 M)时,可获得均匀致密,呈片状规整排列的微纳米结构氧化钛涂层,表面粗糙度为350.7 nm。
参考文章:
药物洗脱支架的技术、产品和市场
突破卡脖子技术,国产可吸收镁合金支架有望年内进入临床试验
镁合金支架-技术直通车
新型涂层显著改善镁合金血管支架疗效
药物洗脱支架的前世今生











