个性化,机械强度高且可生物降解的冠状动脉支架
2020-12-16
生物可降解冠状动脉支架是永久性支架的替代品。这些设备被设计为在血管愈合后降解,留下再生的动脉。临床上可用的可生物降解支架的最初一代需要比不可降解支架厚得多的支撑杆(约150μm),以确保足够的机械强度。然而,这些较粗的支柱被证明是支架临床失败的关键因素。当前的挑战是制造具有薄的支柱和足够的机械强度的支架。
近日,乔治亚理工大学生物医学工程系的Adam W. Martinez团队在ACS Macro Letters期刊上发表了题为“Personalized, Mechanically Strong, and Biodegradable Coronary Artery Stents via Melt Electrowriting”的文章,阐述了他们在生物可降解冠状动脉支架方面的研究。brb
该文章描述了一种自底向上,与基础聚合物相比具有超细纤维和卓越机械性能的可生物降解复合材料支架的增材制造方法。具体来说,熔融电写(MEW)可用于3D打印具有细支杆(60-80μm)和支架应用所需的高度几何复杂性的复合结构。此外,这项技术还允许根据患者的独特解剖结构和疾病状态对个性化支架进行增材制造。此外,研究者证明了聚己内酯还原的氧化石墨烯纳米复合材料与原始聚己内酯相比具有优异的机械性能,且不会损害该材料的细胞相容性,并且可以用这些材料制造可定制的支架状结构,其撑杆的厚度为60μm,远低于临床使用的目标值。
永久性支架在大约一年后血管会萎缩。可生物降解冠状动脉支架最近成为永久性支架的一种很有吸引力的替代品,因为它们可以在血管再生过程中支持血管,降解并最终吸收为分子副产物,通过克雷布斯循环代谢,从而留下修复后的动脉。这将消除晚期并发症的风险。尽管可生物降解的支架具有潜在的优势,但首个临床可用的设备——Abbott Vascular的生物可吸收的血管支架在临床试验中表现出较高的晚期血栓形成率,因而被市场淘汰。它的临床失败可以部分归因于不良的生物材料选择和支架设计。这些设备是由聚L-乳酸(PLLA)制成的,尽管它为设备提供了所需的生物降解性能,但该材料却缺乏所需的机械性能。
开发能够制造具有足够机械强度的可生物降解支架的生物材料系统和技术是可生物降解支架能够实现其临床和经济潜力之前必须解决的主要挑战之一。此外,确定可靠的自底向上制造技术还可以用于开发和制造个性化支架。通过使用新兴的熔体电写(MEW)增材制造技术结合聚己内酯还原氧化石墨烯(PCL-rGO)来生产具有细支杆(<80μm)的可定制化支架状结构,研究者在这方面取得了重大进展。
PCL之所以被选作支架的基础材料,是因为其在许多医疗器械应用中作为可生物降解的材料在临床和法规上得到了良好的实践证明。它的熔点较低,有利于通过熔体技术进行制造。同时还具备缓慢的降解速度以及良好的机械性能但是,与传统的支架材料如钴铬相比,PCL的机械性能较差。因此研究者开发了PCL-rGO纳米复合材料,以改善设备的机械性能。石墨烯及其衍生物作为纳米填料已引起了广泛的关注,因为它们已显示出可在非常低的浓度下改善聚合物的机械性能,部分原因是它们作为二维材料的纵横比非常高。因此,它们已被用于组织工程,药物递送,生物传感和纳米医学等领域。研究者选择了还原的氧化石墨烯,因为与氧化石墨烯(GO)相比,它已显示出与血液具有良好相互作用,而氧化石墨烯会导致血小板活化和聚集。
通过改变PCL中rGO(还原的氧化石墨烯)的重量分数(0.1%,0.3%,0.6%和1.0%),制备了四种PCL-rGO纳米复合材料。所有材料中rGO都没有明显聚集。对PCL,GO,rGO和PCL-rGO 0.1%纳米复合材料的拉曼光谱分析显示GO成功还原为rGO,并且纳米复合物中存在rGO。具体地,如先前所述,观察到D带与G带的强度之比(ID / IG)从GO的1.01降低到rGO的0.95。熔融浇铸的PCL-rGO纳米复合材料的单轴拉伸和压缩特性如表1所示。加入rGO后,力学性能有了显着改善。具体而言,复合材料的拉伸模量随rGO浓度的增加而增加。在最低的rGO加载量(0.1%)下,纳米复合材料的杨氏模量(212±39 MPa)增加了1.6倍,最大拉伸强度(34±5 MPa),断裂伸长率(6.6±1.0 mm / mm)和断裂应力(33±5 MPa)。这些结果与以前的报道相似,在相同的rGO加载量下,样品中的拉伸模量提高了1.7倍,拉伸强度提高了3倍。先前已经提出,在较高的载荷下(高达1.0%)观察到的拉伸强度降低是由于石墨烯纳米片的部分剥落引起的。PCL-rGO纳米复合材料的压缩力学性能显示出随着rGO负荷的增加而呈浓度依赖性增加(表1)。尚未评估纳米复合材料的水接触角。但是,先前的研究表明,在PCL-rGO纳米复合材料中包含rGO后,预计接触角会有小幅增加。
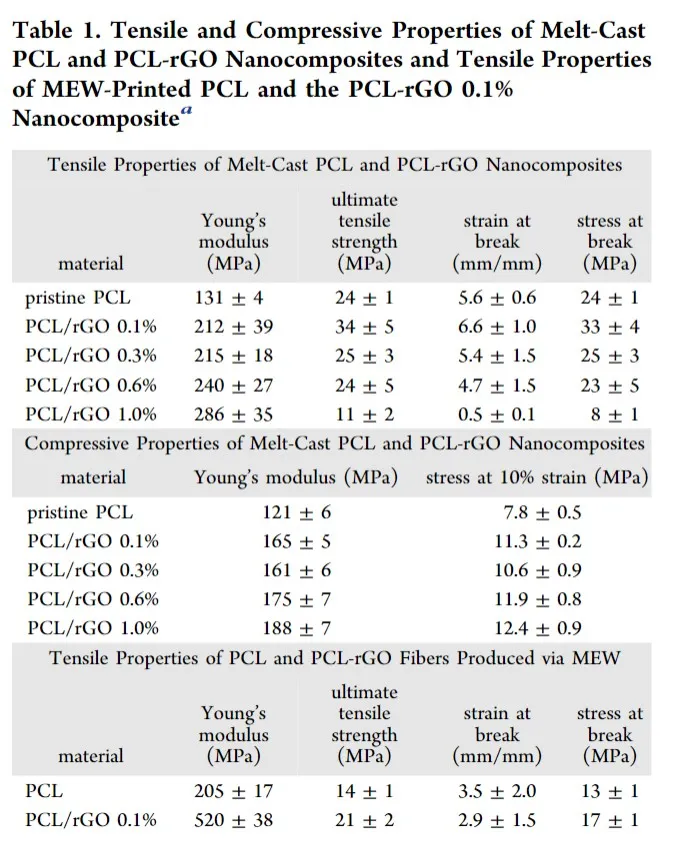 表1 熔融铸型PCL和PCL-rGO纳米复合材料的抗压和压缩性能以及MEW印刷的PCL和PCL-rGO 0.1%纳米复合材料的拉伸性能
表1 熔融铸型PCL和PCL-rGO纳米复合材料的抗压和压缩性能以及MEW印刷的PCL和PCL-rGO 0.1%纳米复合材料的拉伸性能
对MEW印刷纳米复合材料的能力进行评估,发现PCL-rGO 0.1%纳米复合材料显示出最一致和可再现的印刷性能。该制剂可用于支架制造。由于微米和纳米级的结构变化,聚合物加工会对材料的机械性能产生重大影响。因此,评估了原始PCL和PCL-rGO 0.1%熔体电纺丝的拉伸性能(表1)。相对于PCL纤维(205±17MPa和14±1 MPa),观察到0.1%的PCL-rGO纤维的杨氏模量(520±39 MPa)增加了2.5倍,极限抗拉强度(21±2 MPa)增加了1.5倍,分别)。热分析表明,加入rGO可以产生与原始PCL相比更具结晶性的材料,可能是通过充当成核剂来实现的,有望进一步提高材料的强度(图S4)。有趣的是,纯PCL和0.1%纳米PCL-rGO纳米复合材料的加工与其熔融浇铸的等效材料相比,机械性能显着提高。这些结果表明,该加工进一步提高了材料的强度。与由PCL制成的设备相比,PCL-rGO 0.1%纳米复合材料的改善的机械性能将允许制造具有更薄支柱的可生物降解支架。
 图1 使用MEW由PCL-rGO 0.1%纳米复合材料生产的支架状结构:(a)D = 2.0 mm,多种支撑几何形状;(b)D = 3.5mm,0.5mm×0.5mm支柱间距; (c)D = 3.5毫米,1毫米×1毫米支柱间距; (d)D = 3.5毫米,多种支撑几何形状;(e)D = 3.5毫米,多种弯曲的支撑几何形状;(f)D = 3.5毫米,多个笔直和弯曲的支撑几何形状;(g)D = 3.5毫米,具有多个弯曲的和直的支撑几何形状;(h)D = 3.5毫米,弯曲的支柱几何形状;(i)D = 5.0 mm,具有多个弯曲和直的支撑几何形状。所有支架的长度均为20 mm
图1 使用MEW由PCL-rGO 0.1%纳米复合材料生产的支架状结构:(a)D = 2.0 mm,多种支撑几何形状;(b)D = 3.5mm,0.5mm×0.5mm支柱间距; (c)D = 3.5毫米,1毫米×1毫米支柱间距; (d)D = 3.5毫米,多种支撑几何形状;(e)D = 3.5毫米,多种弯曲的支撑几何形状;(f)D = 3.5毫米,多个笔直和弯曲的支撑几何形状;(g)D = 3.5毫米,具有多个弯曲的和直的支撑几何形状;(h)D = 3.5毫米,弯曲的支柱几何形状;(i)D = 5.0 mm,具有多个弯曲和直的支撑几何形状。所有支架的长度均为20 mm
传统上,支架是通过激光切割生产的,尽管该技术能够生产出具有细支柱的设备,但无法方便地制造个性化的支架。相反,标准的增材制造技术(例如熔融沉积)可以轻松进行个性化设计。然而,这些技术没有足够的打印分辨率,并且通过这些技术制成的支架具有厚的支撑杆(150-600μm)。3D打印技术需要数十微米的分辨率,才能从底向上制造个性化支架。自下而上的制造技术的数量在最近几年中迅速增长,包括基于挤压的方法和基于光的方法。在这项工作中,我们选择使用MEW,这是一种3D打印技术,该技术使用高压充电并因此在沉积过程中拉伸了挤出的纤维。印刷聚合物熔体具有高粘度和低导电性,可沉积直径小于5μm的沉积纤维网,可通过直接书写的方式逐层沉积至毫米高度。此外,MEW具有良好的记录轨迹记录医学级PCL的增材制造设备,这将有助于临床翻译。MEW还具有优于数字光处理方法的优势。虽然可以使用光处理技术来制造相似的结构,并可能在可处理的材料类型中提供更大的灵活性,但这些技术通常依赖于可商购的单体和具有反应性物种(例如丙烯酸环氧基团)的大分子单体,这些单体在曝光后会聚合。所得聚合物不能完全吸收,并且生物相容性有限。因此,我们和其他人认为,独特的增材制造能力使MEW成为未来开发具有微米级特征(例如可定制的生物可降解支架)的医疗器械的首选方法。
图1展示了使用MEW制作的类似支架的结构的照片。具体来说,我们生产了直径为2.0、3.5和5.0 mm的冠状动脉支架,因为这些是冠状动脉支架的相关尺寸。此外,还实现了多种支架结构,包括弯曲结构、直角结构和不同支柱间距的矩形形状。这些数据表明,支架设计所需的复杂几何结构可以被重复创建,而且支架的几何形状可以被控制,从而实现个性化的支架设计。
 图2 通过MEW生产的PCL-rGO 0.1%支架状结构的SEM图像,具有不同的支架直径,结构,网格尺寸,支撑厚度和支撑曲率
图2 通过MEW生产的PCL-rGO 0.1%支架状结构的SEM图像,具有不同的支架直径,结构,网格尺寸,支撑厚度和支撑曲率
扫描电子显微镜(SEM)显微照片(图2(a-1))显示,可以在微米尺度上生成高度可复制的结构,并且可以生成60μm的支柱厚度。此外,显微照片显示了MEW制作这些结构的逐层方式,这提供了两个独立的机制,可以通过这些机制来调整支撑杆的尺寸和支架的机械性能。首先,可以通过控制沉积丝的直径来控制支柱的宽度,其次,可以通过指定沉积的印刷层的数量来控制支柱的厚度。
对PCL-rGO0.1%熔体电焊支架进行三点弯曲试验。具体地,评估了具有变化的撑杆间距(0.5mm×0.5mm,1mm×1mm)和印刷层数(3层,5层)的MEW支架的性质。结果表明,所有支架都是可弯曲的,并恢复了其原始形状,没有可见的损坏或永久变形的迹象,这是在支架植入过程中所需的关键性能。
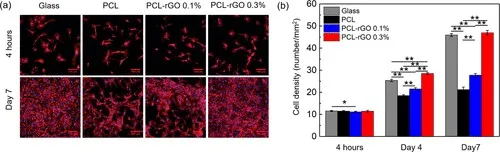 图3(a)荧光显微照片和(b)在7天内定量分析PCL-rGO纳米复合材料上HUVEC的粘附和增殖。在荧光图像中,通过用TRITC-鬼笔环肽染色,细胞骨架显示为红色,通过DAPI染色,细胞核显示为蓝色。比例尺代表100μm。星号(*)表示统计差异,其中* = p <0.05和** = p <0.01。平均值计算为三个独立测试的平均值
图3(a)荧光显微照片和(b)在7天内定量分析PCL-rGO纳米复合材料上HUVEC的粘附和增殖。在荧光图像中,通过用TRITC-鬼笔环肽染色,细胞骨架显示为红色,通过DAPI染色,细胞核显示为蓝色。比例尺代表100μm。星号(*)表示统计差异,其中* = p <0.05和** = p <0.01。平均值计算为三个独立测试的平均值
支架的设计必须尽量减少与生物环境的不良相互作用,例如引起血栓形成。因此,评估了rGO负载对蛋白质从血清中吸附,内皮细胞粘附和生长以及血小板粘附和铺展的影响。选择内皮细胞和血小板是由于它们在凝血级联中的作用。内皮细胞在血管腔内形成单层衬里,功能正常的内皮使血管具有与血液的相容性。与此相反,重要的血小板粘附和扩散是血栓形成的标志。因此,需要促进内皮细胞粘附和生长并最小化血小板粘附的材料。在原始PCL,0.1%的PCL-rGO和0.3%的PCL-rGO的膜上进行生物学测定。包含0.3%的PCL-rGO可以更好地评估rGO负载对这些关键生物学相互作用的一般影响。细胞与生物材料界面的粘附通常受一层吸附蛋白的调节。因此,我们期望观察到内皮细胞和血小板相互作用随rGO负荷的变化而变化。图3所示的荧光显微照片显示了初始人脐静脉内皮细胞(HUVEC)的粘附在所有表面上都相似。另外,细胞能够在所有表面上增殖。这些观察结果通过量化数据得到了证实。粘附4小时后,所有表面支撑着相似数量的细胞。然而,rGO的添加以剂量依赖性的方式提高了细胞增殖速率,在第7天玻璃样对照和PCL-rGO 0.3%的表面均支持接近铺满的单层细胞。这些结果表明,与原始PCL相比,PCL-rGO纳米复合材料可以更好地内皮化。
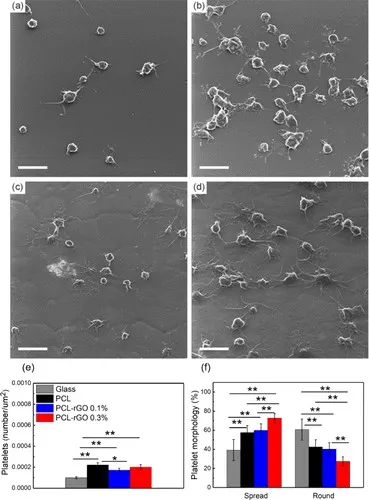 图4 血小板(a)玻璃,(b)原始PCL,(c)PCL-rGO 0.1%和(d)PCL-rGO 0.3%上的血小板粘附的代表性SEM图像。比例尺代表5μm。(e)量化血小板的表面密度和(f)其形态
图4 血小板(a)玻璃,(b)原始PCL,(c)PCL-rGO 0.1%和(d)PCL-rGO 0.3%上的血小板粘附的代表性SEM图像。比例尺代表5μm。(e)量化血小板的表面密度和(f)其形态
还评估了血小板粘附,结果如图4所示。血小板能够粘附于所有表面,并且观察到圆形和部分散布的血小板的混合物。定量时,尽管PCL-rGO0.1%的表面显示出较小的但统计学上显着的血小板粘附性降低,但在所有表面上均观察到了相似的血小板粘附性。还评估了血小板的形态,因为散布形态表明血栓形成行为的激活。发现原始的PCL和PCL-rGO 0.1%表面导致统计学上相似的血小板散布,而在PCL-rGO 0.3%表面上观察到血小板散布增加。这些数据表明,与PCL相比,PCL-rGO 0.1%纳米复合物中的rGO负载不会增加血栓形成性。PCL-rGO 0.1%纳米复合材料的可印刷性以及与PCLcontrol相比改善的机械性能和改善的内皮化技术支持使用这些材料在可生物降解的支架应用中。此外,这是MEW首次用于在支架应用中创建具有细支杆(〜60μm)的复杂复合结构。MEW可以轻松控制支架直径,支杆厚度,支杆间距和支杆几何形状,从而有可能实现下一代可生物降解支架的开发,并增强个性化支架的自下而上制造。
该研究为开发下一代可生物降解的冠状动脉支架奠定了基础,为未来的工作奠定了基础。这将包括使用诸如光学相干断层扫描等特定于患者的数据制造个性化结构;开发计算工具,以设计具有适当机械性能且对血流指标的影响降至最低的特定于患者的支架等应用。
文章及图片来源:EngineeringForLife公众号











