2024上海医疗器械创新展Medtec详解2个眼药缓释递送创新案例看医工融合
2024-06-13
01、前言
医学创新研究中医工融合可以带来跨学科的思维碰撞和合作,通过将临床需求和工程技术相结合,可以打造出更加创新和实用的眼科产品和服务,满足市场的真实需求。在眼科领域,例如通过工程学的方法设计和改进医疗器械,可以提高眼科手术的精准度和安全性。例如随着科技的进步,涌现出越来越多的新技术和新材料被应用到眼科手术治疗,如人工晶体、激光治疗等。
1.1 眼科学(临床医学)
以终为始的立项机制,需要解决市场中的什么问题,临床是终点也是起点。另外从疾病机制出发,研究适应证的病理机制,为所开发药物的MOA提供理论基础。同时,药物的开发更离不开临床研究,需要进行临床试验以评估新型药物递送系统的安全性和有效性。
以下笔者解析一篇日常学习的文献,文章列举了两个创新开发的案例,笔者发现挺有趣的是,两个案例刚好分别从临床/市场需求和工科/解决方案出发的创新,遂在本文医工融合视角作下分享。
2024年5月17日英国利物浦大学眼与视觉科学系研究团队发表在「Nature」子刊「Eye」的「Sustained-release drug delivery systems」即「药物缓释递送系统」。
文章以眼部药物缓释递送系统的开发为讨论主题。通过临床需求的了解,同时了解如何修改或设计具有特定功能特性的新材料,可以带来改善治疗方案的新战略机会。重点讨论了两个案例:1)如何用天然来源的抗菌材料合成肽水凝胶,从而设计出可预防术后感染的绷带镜;2)如何使用硅油填充物用于治疗复杂性视网膜脱离。
我国眼部疾病主要以眼部炎症、白内障、青光眼、干眼病、视疲劳、近视眼等为主,针对这些疾病,眼科医疗器械设备也在不断进行创新。作为一个“药物+器械+服务”三位一体的黄金赛道,从发展增速来看,植入耗材国产替代使得眼科器械市场增速最快,而由于眼科专病高度细分,技术要求较高,目前眼科药品和器械国产发展处于初期阶段,均以进口为主,未来国产替代空间较大。为助力我国眼科医疗器械行业的发展,2024上海医疗器械创新展Medtec将在今年的展会现场首次举办消费医疗专场论坛D:眼科专场论坛,本次会议将主要围绕眼科高值耗材及器械设备展开,探讨眼科未来发展趋势,技术壁垒解决方法及国产化进程。点击注册参观参会>>>
02、未满足的需求及创新进展
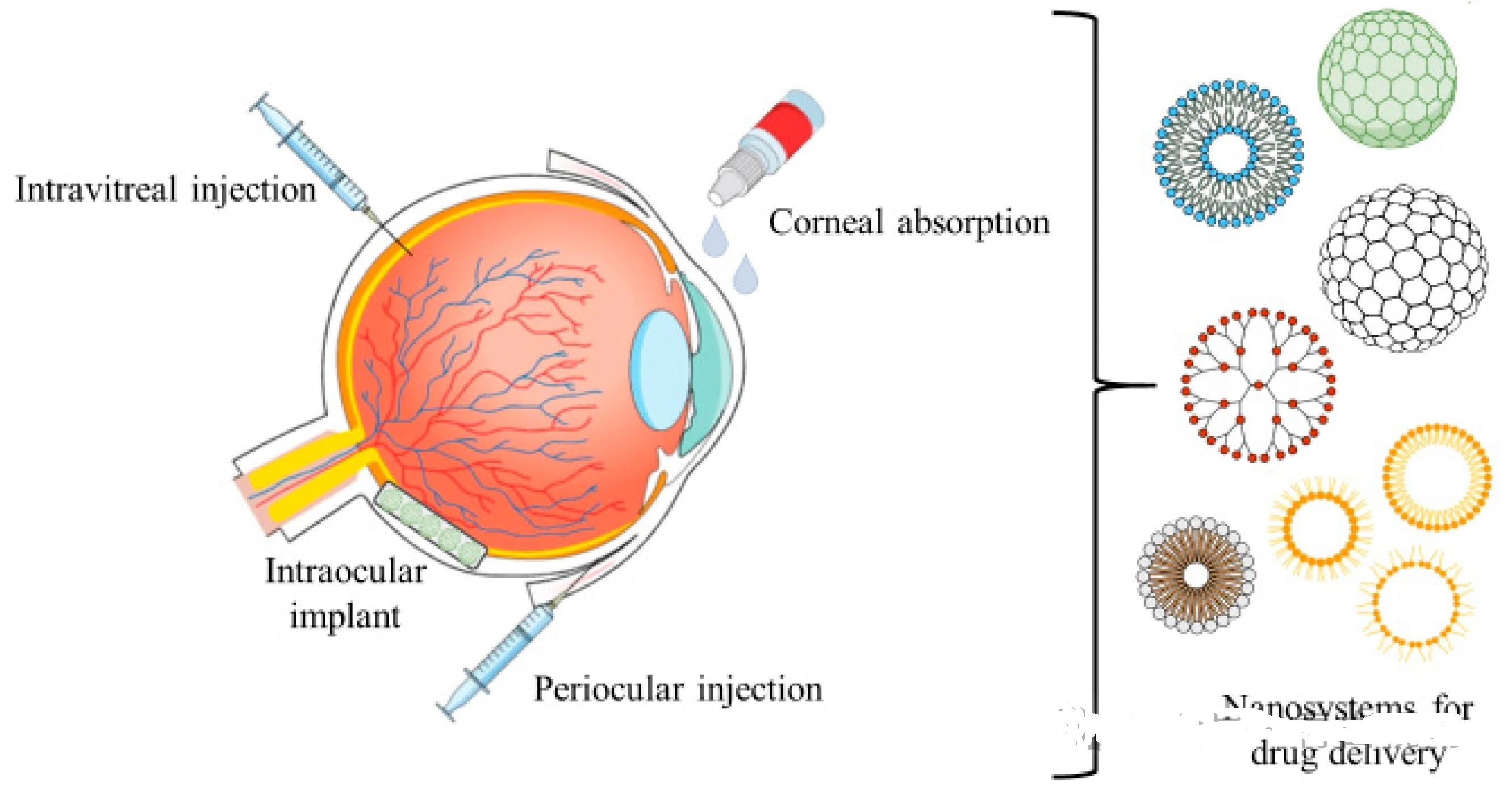
大多数活性药物成分(API)是通过局部滴眼液给药。然而,众所周知,这是在相关组织中达到 API 治疗水平的低效方法。患者自己使用滴眼液可能很困难,并且大量的滴眼液会因眨眼迅速从眼睛中排出,或者通过泪管。API 进入眼组织,特别是到达眼后节也存在解剖学和生理学障碍。
为了使 API 更有效地分布到眼前节组织中,目标是增强组织对 API 的渗透性并延长 API 与这些组织的接触时间;在实现这一目标方面,局部制剂已经取得了重大进展。在眼后节组织中实现治疗水平的 API 的最有效方法是将其直接注入眼后节。但频繁注射到眼后节有很多缺点,因此目标是通过每次注射提供受控和持续缓释的API水平。可以利用对已用于眼部的合成材料或具有合适特性的新材料的材料科学的理解,来开发缓释药物递送系统以增强治疗效果。但适当的解决方案将取决于 API、目标组织和所需的治疗方案,详细见以下表1,表2。
表1 :不同药物递送系统及其优缺点

表2 :不同制剂类型的优劣势
对于将药物递送到眼表,最简单的方法是增加 API 与组织接触的停留时间。许多研究旨在通过生产软膏、乳剂和凝胶来增加制剂的粘度来实现这一目标。还可以使用粘度增强剂来增加 API 的溶解度,从而提高其对眼组织的生物利用度。另一种经过充分研究论证的方法是使用隐形眼镜作为药物递送载体。亲水性隐形眼镜可以简单地将局部应用的 API 捕获在镜片和角膜表面之间的泪膜层中,从而增强 API 在眼表的停留时间,或者将隐形眼镜优化为用作特定 API 的储存器,从而随着时间的推移提供增强的 API 释放曲线。许多研究涉及市售隐形眼镜以及将 API 从溶液中简单吸收到其结构中,并通过扩散控制 API 的释放。然而,也有机会以其他形式(例如颗粒、薄膜、乳液和脂质体)掺入 API,以改变其溶解度,从而改变 API 的生物利用度、负载浓度和释放速率。药物递送的优化需要考虑隐形眼镜的材料特性、API 的化学性质以及 API 在隐形眼镜内的尺寸、配方和分布,以达到适当的治疗剂量。
用于将 API 应用至眼后节组织的局部递送方法(使用上述任何方法来增强生物利用度和停留时间),将有助于增加这些 API 通过房水的玻璃体途径、葡萄膜/巩膜途径的转运通过施累姆氏管引流或通过结膜脉管系统的眼周路径。然而,达到所需眼后节组织的 API 水平受到许多生理障碍的严重限制。通常认为,直接玻璃体内递送是这些治疗的最有效的给药途径,尽管也有其缺点。现有大量研究报道了通过将 API 的配方优化为微米或纳米颗粒、乳液、脂质体或固体可降解或不可降解植入物来增强 API 控制和持续递送的方法。利用对 API/制剂与生物环境相互作用的材料科学的理解来优化向所需组织的治疗递送,还有广泛的开发前景。
03、眼药缓释递送的创新探索
文章主要讨论了两种创新开发材料以产生持续治疗效果的方法。案例一,在肽水凝胶隐形眼镜的开发过程中,临床需求的明确和材料特性的优化相辅相成,最终实现了具有预防感染功能的绷带隐镜。案例二,在硅油填充物的研究中,材料科学的理解和药物化学的创新使得视黄酸的持续释放成为可能。
3.1 ε-聚赖氨酸水凝胶绷带镜的创新与应用:从工科出发
使用天然来源的抗菌材料合成肽水凝胶,可以设计出可预防性使用的绷带隐形眼镜。这种隐形眼镜不仅能够延长API在眼表的停留时间,还具有抗菌特性,从而减少术后感染的风险。通过调整水凝胶的密度、交联二羧酸的长度和交联密度,可以合成具有不同机械性能和抗菌特性的新型水凝胶。这种方法展示了材料科学在优化眼表药物递送系统方面的巨大潜力。
3.1.1 ε-聚赖氨酸水凝胶的合成
ε-聚赖氨酸通过肽键连接形成,带有正电荷的线性肽链。利用二羧酸和N-羟基琥珀酰亚胺 (NHS)/1-乙基-3-(3-二甲基氨基丙基)碳二亚胺 (EDCI) 交联技术,可以将ε-聚赖氨酸合成为水凝胶。这种交联过程允许通过调整聚合物的密度、交联二羧酸的长度(即两个羧酸基团之间重复烷基的数量)和交联密度(即参与交联的α-胺基团的比例),来获得一系列具有不同机械性能和抗菌特性的水凝胶。通过上述方法合成的水凝胶可以具有足够的机械强度、透明度和含水量,使其成为潜在的绷带镜。例如,使用密度为0.071 g/cm³的聚合物和辛二酸(C8)作为交联剂,以60摩尔%的交联密度制备的水凝胶,其弹性模量为0.6 MPa,折射率为1.390,含水量约为70%,这些指标与市售水凝胶隐形眼镜相当。
1.2 ε-聚赖氨酸水凝胶的抗菌特性
ε-聚赖氨酸的抗菌特性主要来源于其多阳离子特性及其破坏细菌细胞壁的能力。然而,当ε-聚赖氨酸交联形成水凝胶时,其抗菌活性可能会减弱。这是因为交联过程中带正电的α-胺基链数量减少。在60%交联的水凝胶中,仍有40%的游离胺基可用于进一步共价结合更多的ε-聚赖氨酸肽,这样可以增加带正电的胺基与细菌细胞壁的相互作用,从而增强抗菌活性。此外,含有羧酸基团的抗生素,如莫西沙星和美罗昔康,可以通过静电作用结合到水凝胶上,进一步增强抗菌效果(图1)。
1.3 ε-聚赖氨酸水凝胶绷带镜的应用
角膜手术后,患者通常需要使用绷带隐形眼镜以促进愈合。然而,目前市售的绷带镜通常不具备抗菌特性。通过设计具有抗菌特性的绷带镜,可以显著降低术后感染率。例如,研究人员发现,使用ε-聚赖氨酸制成的水凝胶对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、白色念珠菌和卡氏棘阿米巴等微生物具有显著的抗菌作用。铜绿假单胞菌是导致微生物性角膜炎(MK)的主要病原体之一。实验表明,带有侧链ε-聚赖氨酸的水凝胶能够显著抑制铜绿假单胞菌的生长。与市售水凝胶绷带镜相比,ε-聚赖氨酸水凝胶在高接种密度(10⁷ CFU)下仍能有效抑制细菌的附着和生长(图2,图3)。棘阿米巴角膜炎是一种与佩戴隐形眼镜相关的严重感染,尽管这种感染较为罕见,但其后果可能非常严重。研究表明,与市售水凝胶绷带镜和氯己定标准治疗相比,带有侧链ε-聚赖氨酸的水凝胶在对抗棘阿米巴包囊和滋养体方面表现出更高的效力。实验结果显示,带有侧链ε-聚赖氨酸的水凝胶对棘阿米巴的毒性水平与氯己定类似(图4)。这些研究表明,带有侧链ε-聚赖氨酸的水凝胶具有显著的抗菌特性,对铜绿假单胞菌和棘阿米巴感染有强大的抑制和杀菌效果。通过这些材料,可以开发出更有效的防感染隐形眼镜和治疗方法。
1.4 未来的研究方向
虽然ε-聚赖氨酸水凝胶绷带镜展示了显著的抗菌效果,但在实际应用中仍需克服一些挑战。如需要进一步优化水凝胶的机械性能和抗菌活性,以确保其在临床应用中的安全性和有效性。其次,由于此类绷带镜被归类为药械组合产品,其监管审批过程可能更加复杂,需要进行大量的临床试验以验证其安全性和有效性。
图1:ε-聚赖氨酸绷带镜。A. 水凝胶结构示意图,显示潜在的API结合位点;B. 展示隐形眼镜制柔韧性;C. 可以通过羧基团结合的潜在API。
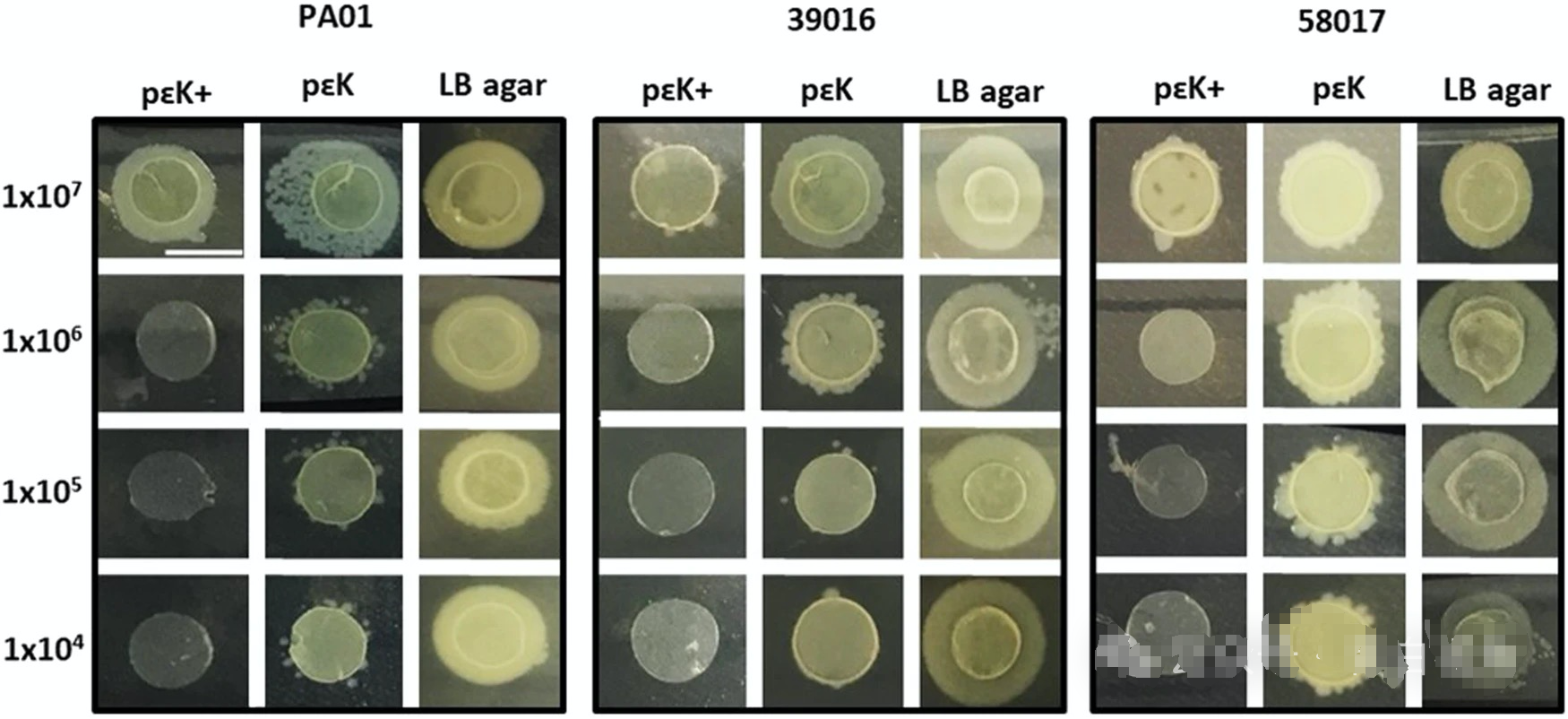
图2:带侧链ε-聚赖氨酸的聚赖氨酸水凝胶(pεK+)、ε-聚赖氨酸水凝胶(pεK)和LB琼脂圆片对铜绿假单胞菌生长的抑制效果。
图3:带侧链ε-聚赖氨酸 (pɛK+) 的ε-聚赖氨酸水凝胶与ε-聚赖氨酸 (pεK) 水凝胶和商业水凝胶 CL 对铜绿假单胞菌分离株的抗菌活性进行比较。与 pεK 水凝胶和商业水凝胶 CL 相比, PBS 缓冲液中的存活铜绿假单胞菌( A、C ) 以及与 pεK+ 水凝胶相关的活铜绿假单胞菌 ( B、D )。将 PεK+ 水凝胶、pεK 水凝胶和商业水凝胶 CL 以 10 3 ( A , B ) 和 10 6 ( C , D ) CFU接种铜绿假单胞菌(PAO1、PA39016 和 PA58017)24 小时。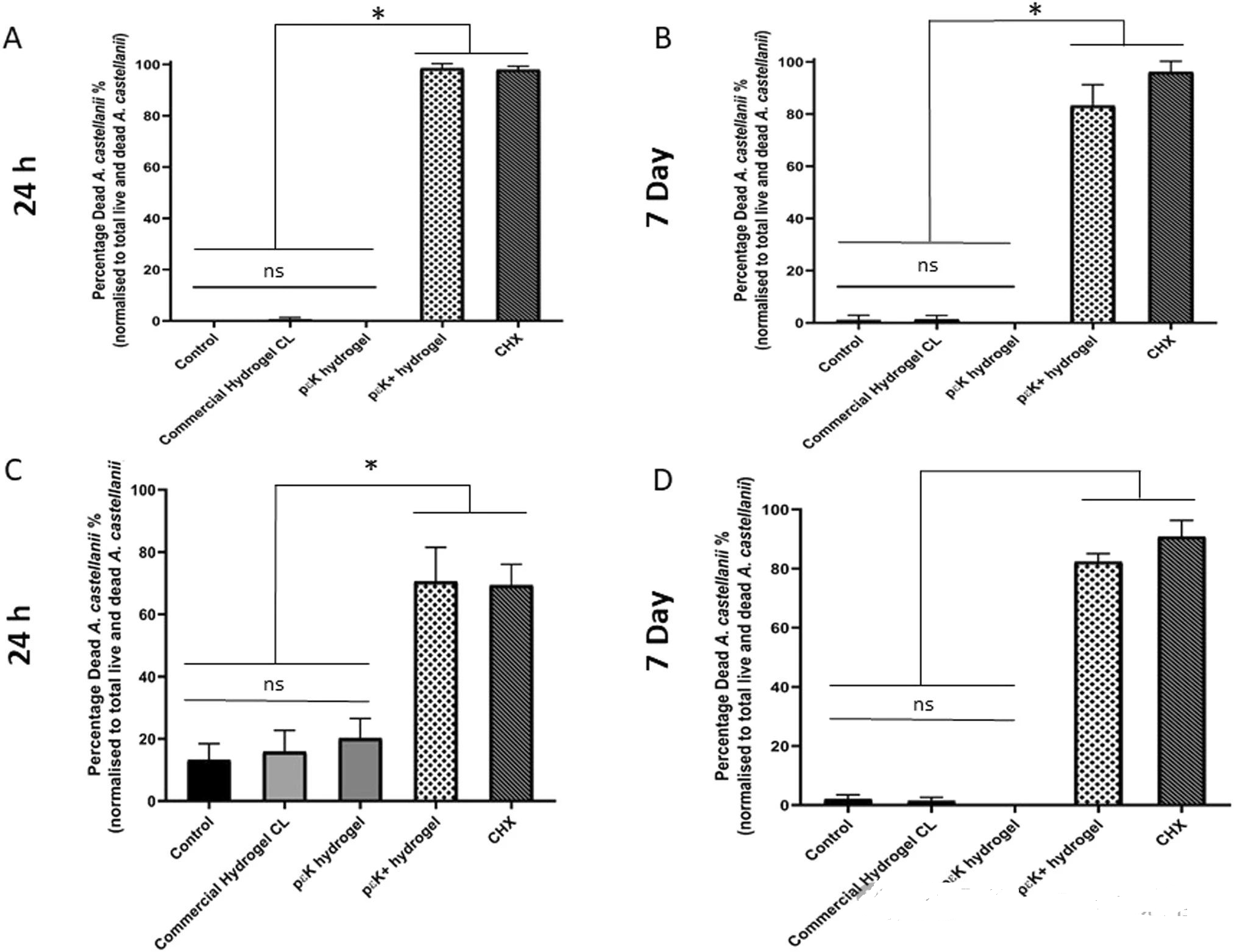
图4:与ε-聚赖氨酸 (pεK) 水凝胶和商业水凝胶 CL 相比,带侧链ε-聚赖氨酸的ε-聚赖氨酸水凝胶对卡氏棘阿米巴的毒性。图表显示 24 小时死亡滋养体的百分比;B图显示7天时死亡滋养体占存活和死亡滋养体总数的百分比;C图显示24小时时死亡包囊的百分比;D图显示7天时死亡包囊占活和死滋养体总数的百分比;氯己定是阳性对照。实验一式三份进行(n = 3),每个实验三个孔,每个孔有五个视野。
3.2 硅油填充物的改良与应用:从临床出发
视网膜脱离是需要紧急处理的眼科疾病。硅油填充物可以用于治疗视网膜脱离,通过增强抗增殖药物视黄酸的溶解度,并实现持续释放,从而提供长效治疗效果。这种方法结合了材料科学与药物递送技术,通过调整硅油的特性和药物的配方,优化了药物在眼后节组织中的释放曲线,显著提高了治疗效果。
3.2.1 现状及挑战
几十年来,硅油填充物在治疗复杂性视网膜脱离方面取得了显著成功。这归功于聚二甲基硅氧烷聚合物的化学特性,特别是其疏水性。这种疏水性使得硅油能够有效地排除房水和炎症介质,支持视网膜裂孔的愈合,同时将视网膜稳固地固定在下层组织上。近年来对硅油的改良主要集中在改变聚合物的分子量以增加其粘度和减少乳化,或者添加半氟化烷以增加填充物的比重,从而改善视网膜脱离的治疗效果。
3.2.2 解决方案
增生性玻璃体视网膜病变(PVR)是视网膜脱离的主要并发症之一。研究人员评估了硅油填充物递送亲水性或疏水性抗增生API的潜力。然而,由于硅油中的API溶解度差,导致API负载量低、无效及释放不受控制,这可能会导致毒性问题。为了解决这一问题,研究人员采取了两种不同的方法:一种是设计短链共聚物,另一种是设计可溶于硅油的聚二甲基硅氧烷-API缀合物。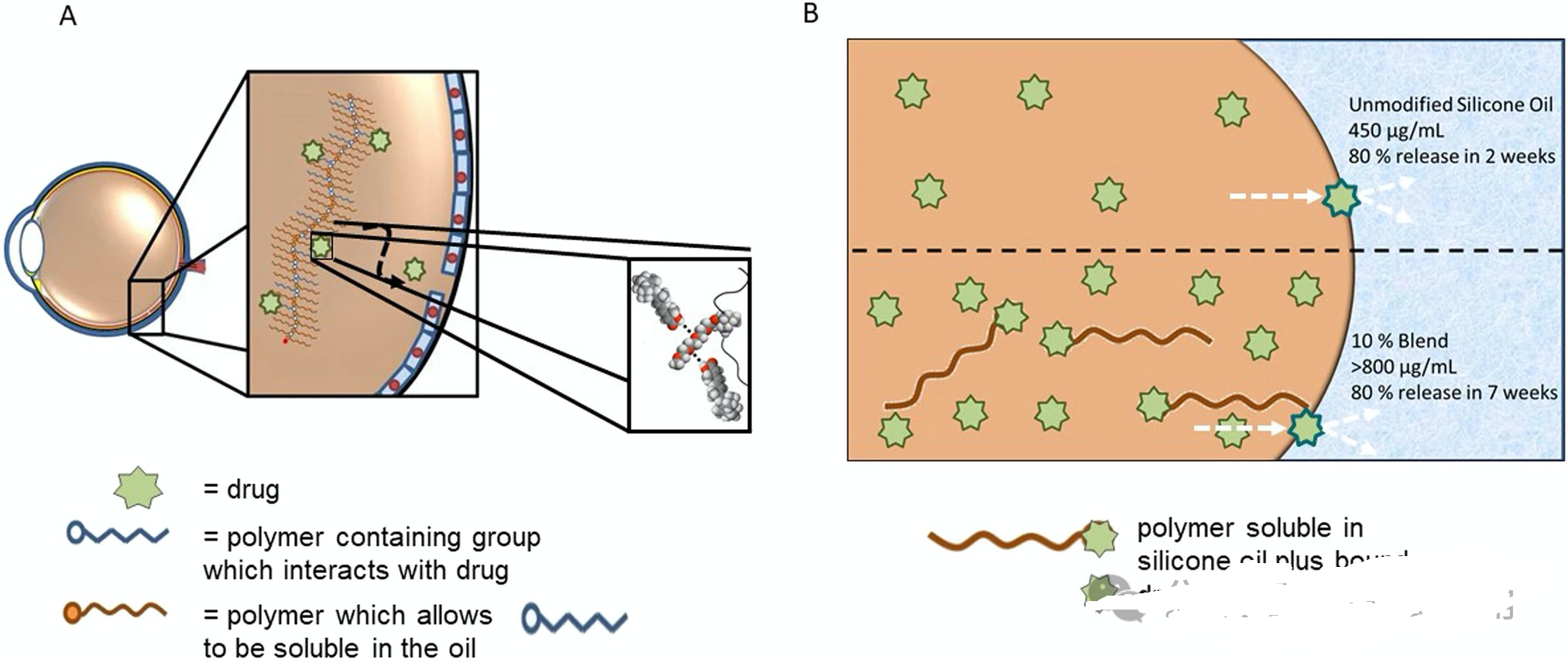
图5:用于增加溶解度和释放的硅油-API 改性策略的示意图。A:使用 RAFT 聚合将 API分子与甲基丙烯酸酯化聚二甲基硅氧烷 (PDMSMA) 和甲基丙烯酸酯化乙二醇 (OEGMA) 的接枝共聚物共溶解在硅油中;B:短链羟基封端的聚二甲基硅氧烷和 全反式维甲酸(atRA)通过酯化反应共溶 API 结合物。
1)短链共聚物的设计
在第一种方法中,使用RAFT聚合设计并合成了甲基丙烯酸酯化聚二甲基硅氧烷(PDMSMA)和甲基丙烯酸酯化乙二醇(OEGMA)的接枝共聚物。这些共聚物的设计目的是在硅油中增强API的溶解度。PDMSMA促进在硅油中的溶解度,而OEGMA通过氢键促进亲水API的溶解度。合成了不同比例和分子量的共聚物,最终确定由90 wt%的较短分子量PDMSMA和10 wt%的OEGMA组成的共聚物在硅油中的溶解度最佳。发现,将这些共聚物以5 v/v%或10 v/v%的浓度添加到硅油填塞物中,并以20 µg/mL或200 µg/mL的浓度溶解全反式视黄酸(atRA),可以显著延长API的释放时间。例如,添加20 µg/mL atRA时,共聚物将80% API的释放时间从9天延长到40天;添加200 µg/mL atRA时,共聚物可以将API的释放时间延长至72天。
2)硅油-API缀合物的设计
在第二种方法中,通过酯化反应合成了短链羟基封端的聚二甲基硅氧烷和atRA之间的API缀合物。这些缀合物的设计目的是改变硅油的溶剂特性,从而增加API的负载并减缓游离atRA的释放。研究表明,配方中API缀合物含量的增加使得更多的游离atRA溶解在硅油中,从而延长了API的释放时间。具体而言,通过添加10%的API缀合物,可以将未修饰的atRA的释放时间从2周延长至50天左右,这已被认为是治疗增生性玻璃体视网膜病变(PVR)的合适时间。
3.2.3 结果与讨论
这些研究表明,利用硅油填充物的化学性质可以有效改变亲脂环境,并通过设计能够与特定API相互作用的功能分子,结合促进硅油溶解度的官能团,可以在几周内以治疗水平调整API的释放。优化这些配方不仅能够延长药物的递送时间,还能减少对油物理性质的不利影响,如粘度和透明度。改良硅油填充物以增加API的溶解度和控制其释放,是治疗复杂性视网膜脱离及其并发症的创新策略。这些改良方法展示了通过化学设计和优化,可以显著提升治疗效果,为患者提供更持久、更有效的治疗选项。
04、结语
以上案例创新研究成果的取得都离不开临床眼科医生、材料科学家,此外还有化学家之间的密切合作。多学科的合作模式,使得各领域的专业知识得以结合,带来了全面的理解和创新的解决方案。
多年来,药物缓释递送领域已有科学家进行了大量研究,但目前能成为产品真正走到临床的不多。从工科角度,必须了解具体的治疗目标和当前治疗方案的局限性,以及目前在医疗器械的使用及其制造材料方面存在哪些机会,而临床医生也可以寻找工科专家作为合作伙伴,可能找到目标适应证的解决方案。工科和临床眼科医生之间建立强有力的合作伙伴关系可以带来创新机会,从而造福患者。
文章来源:











