2025上海医疗器械展览会|增材制造个性化植入物技术发展与挑战
2025-06-16

图片来源:数字医工坊
增材制造(3D打印)技术通过将原材料自动累加的方式制造实体零件,相比于传统的材料成型或机械加工技术,是一种自下而上的材料累加制造方法,仅使用一台3D打印设备就能够制造几何形状复杂和内部材料成分可变的产品,特别适合单件、小批量和定制化产品的低成本制造。未来医疗产品将逐步迈向精准化和定制化,因此,采用增材制造技术成为我国医疗器械产品向精准化、个性化发展的重要机遇。这主要体现在2个方面:①制造技术方面,我国的基础研究和技术发展与国际先进水平较为接近,涌现了一大批具有国际影响力的研究团队,各类增材制造技术装备发展较为全面;②医疗器械应用方面,受益于我国人口众多,为增材制造技术提供了广阔市场空间。
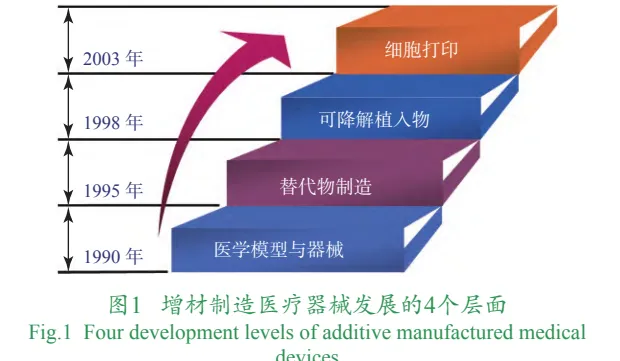
根据原材料和产品的特征,从非生命体的构建到具有生命力活体的制造,增材制造医疗器械发展的4个层面如图1所示。第1层面是体外或短期接触人体组织的Ⅰ类、Ⅱ类医疗器械,例如手术导航模板、医疗模型、假肢矫形器等;第2层面是惰性材料的硬组织替代物,包括骨、关节及口腔等部位的替代物;第3层面是以组织工程支架为代表的可降解医疗器械,这类器械通过在诱导人体自体组织生长的同时自身逐渐降解,最终实现无异物的人体组织修复;第4层面则是活性组织的直接制造,也被称作细胞打印,将细胞和生物因子等具有生命活力的材料作为原材料,通过3D打印技术制造活性组织或器官。
图片来源:数字医工坊
、
2025上海医疗器械展览会指出,目前,第1层面3D打印医疗器械的技术门槛和使用风险较低,第4层面的活性组织3D打印还处在前沿探索阶段,第2、第3层面的惰性硬组织替代物和可降解植入物是3D打印医疗器械研发、产业转化和监管研究的重点。本研究就目前医用3D打印领域中产业转化前景突出的不可降解金属骨植入物、不可降解聚合物骨植入物和可降解植入物的发展进行综述,以期为相关产品的研究和标准化发展提供参考。
1 不可降解金属骨植入物
1.1 发展现状
金属骨植入物是目前3D打印医疗器械产业界发展最快的领域之一,随着金属3D打印技术的快速发展,金属材料被广泛用于硬组织替代物的3D打印,其中钛系、钴铬钼系、钽系合金由于其优良的生物相容性、耐蚀性、抗疲劳性和摩擦磨损性能,获得了广泛的应用。西安交通大学联合原第四军医大学率先实现了3D打印个性化下颌骨金属植入物的临床应用,2015年我国批准了首个3D打印非个性化的髋臼杯假体,2018年批准了首个3D打印的个性化下颌骨植入物。
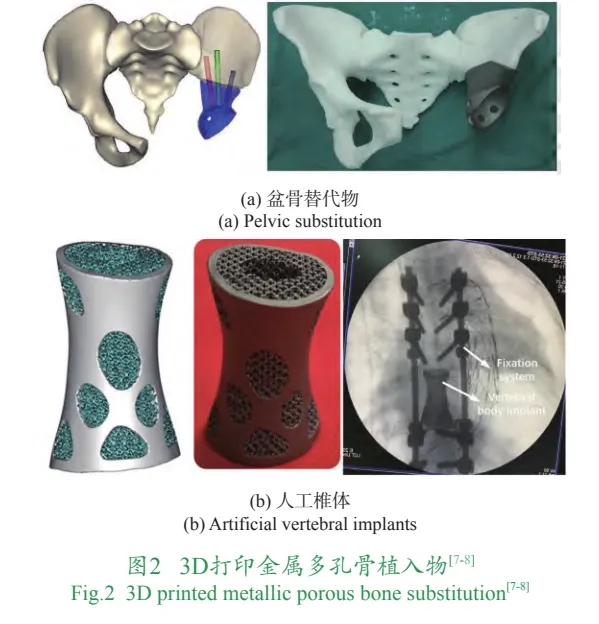
金属3D打印骨植入物不仅能够在外观上与受损骨骼的解剖形态精确对应,而且其制造技术还能构建直径达数百微米的精细可控微孔结构。这些微孔结构不仅为骨组织长入假体内部提供了空间,还能有效避免金属假体产生的应力屏蔽效应。因此,目前进入临床研究和市场的金属3D打印骨植入物一般都具有多孔结构,例如3D打印髋臼杯、椎间融合器、脊柱替代物、股骨头填充棒和髋臼修复假体等。3D打印金属多孔骨植入物如图2所示。
图片来源:数字医工坊
1.2 难点与挑战
金属3D打印骨植入物在多孔结构方面的优势给其设计带来了巨大挑战:多孔结构的设计显著影响骨植入物的力学性能及其植入后的骨重建行为,对骨植入物的性能和功能都有显著影响。在金属3D打印粉末原材料和制造工艺发展成熟的背景下,骨植入物的个性化设计尤为重要。
3D打印骨植入物广泛用于人体各个部位骨骼的修复和重建。SUN等提出了3D打印多孔骨植入物的共性设计准则,包括强度准则、早期稳定准则和远期稳定准则,分别对应多孔骨植入物在临床中的力学安全性、术后即刻固定有效性和长期服役过程中的稳定性。
在强度准则中,他们提出借鉴工程领域安全系数的概念来衡量骨植入物的安全性,即定义骨植入物的安全系数为材料的屈服强度与骨植入物在人体内所受最大应力的比值,如式所示,用以定量评估设计结果的安全系数。
式中,N为骨植入物的安全系数;σs为材料的破坏应力,通常为屈服强度;σmax为骨植入物在服役环境中的最大应力。安全系数N理论上必须大于1,且在设计实践中必须留出安全裕量,因此额定安全系数的选择须考虑骨植入物的服役环境、预期服役时限、力学失效风险等诸多因素。
早期的稳定准则中提出了通过骨和植入物界面的相对微动定量评价植入物在人体内早期稳定性的原理,过量的微动会造成骨/假体界面上形成纤维组织,甚至破坏界面,而在一定阈值内的骨/假体界面微动则能够成为刺激界面上骨生长的激励因素,有助于形成稳定的骨/假体生物固定。一般认为,20~50 μm的微动能够对骨/假体界面整合有促进作用, 50~100 μm的微动可能会对界面融合产生不利影响,但大于150 μm的微动会破坏骨假体界面愈合。
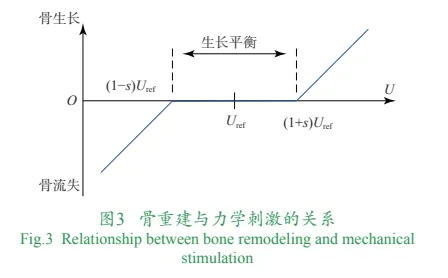
在远期稳定准则中,周围骨组织的重建影响骨组织向多孔结构中的内向生长以及周围骨向植入物提供的稳定骨性支撑。根据Wolff定律,骨组织具有感知载荷变化,动态调整骨吸收和骨形成的能力,在此基础上发展出来的功能性适应理论认为力学刺激与骨组织之间存在一种生理平衡,在一定的刺激范围内,骨的生长与吸收过程相互平衡,大于该范围则引起骨量增加,小于该范围则造成骨流失。骨重建与力学激励的关系如图3所示。根据两者关系提出,设计的多孔骨植入物在承担人体生理载荷时,一方面能够有效将应力传导至周围骨,使周围骨所受力学刺激尽可能处于能够促进骨生长和重建的范围内,从而保障假体能够获得稳定的骨性支撑;另一方面具有适宜于骨组织长入的微观孔隙结构设计,包括孔型、孔径、孔隙率、微杆直径等参数。
图片来源:数字医工坊
1.3 监管发展
以《无源植入性骨、关节及口腔硬组织个性化增材制造医疗器械注册技术审查指导原则(2019年第70号)》为代表[15],我国药品监督管理局先后针对3D打印髋臼杯、人工椎体、椎间融合器、下颌骨等产品出台了产品层面的注册审查指导原则,在共性性能评价方面出台了针对理化性能均一性、等效性模型的指导原则。在个性化金属3D打印骨植入物的设计方面,由于定制式器械“独一无二”的特征,使其难以在临床应用前进行完备的性能评估测试,设计过程中所需的医工交互过程的复杂性、临床应用的特异性等也为定制式骨植入物的设计开发和临床应用带来风险。因此,3D打印金属骨植入物领域当前的发展重点在于建立具有通用性的设计规范和设计准则,并形成标准规范。
我国药品监督管理局在2020年发布了《个性化匹配骨植入物及工具医工交互质控审查指导原则》,对个性化骨植入物设计开发过程中的医工交互要点进行了阐述,为定制式骨植入物的设计开发提供了纲领性指导。目前尚未有细化到骨植入物设计规范和设计准则方面的技术标准。
鉴于金属3D打印骨植入物覆盖产品类别的广泛性,与之相关的设计规范和设计准则方面的技术标准体系发展应遵循“共性-个性”的脉络。首先围绕共性需求和设计准则,建立高级别的技术标准作为主干,然后面向特异性产品建立有针对性的设计规范,使3D打印金属骨植入物的设计标准体系逐步完善。
2 不可降解非金属骨植入物
2.1 发展现状
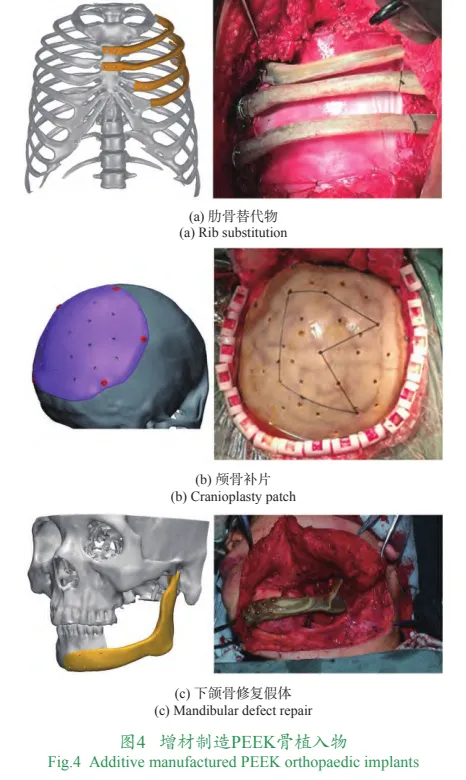
在非金属材料中,陶瓷材料由于自身脆性大,难以用在大尺寸的具有承力功能的骨植入物中,目前多数应用研究集中在小尺寸的骨填充支架方面。在聚合物材料中,聚醚醚酮(polyetheretherketone,PEEK)材料已在植入物中有长期的应用历史。相比于金属材料,PEEK的力学性能与人体自然骨更为接近,有利于生理载荷的传递,可有效改善假体植入人体后的应力遮挡现象。同时,PEEK在X线透射下呈半透明且无伪影,便于影像学观察。因此PEEK材料被视为可替代金属材料的下一代骨植入物材料,目前在躯干、上肢、颅颌等非主要承力部位已经有大量应用。在增材制造PEEK骨植入物临床应用方面,国内的发展处于世界前列。西安交通大学自2017年起使用材料挤出成形3D打印技术制作的定制式PEEK肋骨植入物率先实现了临床应用,后续在颅骨、胸肋骨、下颌骨、肩胛骨等多个部位获得应用,部分案例如图4所示。
图片来源:数字医工坊
增材制造PEEK植入物的产业化发展在2023年取得了重要突破,美国Curiteva公司在2023年通过FDA 510(k)许可获得了国际上首个材料挤出成形的PEEK骨植入物注册证,国内西安康拓医疗公司也在2023年通过我国药监局“创新医疗器械”获得了粉末床熔融PEEK颅骨修补假体的注册证。
2.2 难点与挑战
尽管PEEK骨植入物已经在临床应用和产业化发展取得了成功,但其发展依然面临两方面难点。一方面,PEEK材料自身生物惰性导致难以与人体组织结合,导致PEEK骨植入物存在较高的松动风险;另一方面,现有可用于骨植入物的PEEK材料受到国外厂商垄断,国内行业发展存在“卡脖子”问题。
PEEK材料的生物活性化是生物材料领域的研究热点之一,目前发展的主要策略包括复合材料、涂层、表面化学改性等。在上述措施中,涂层改性通过在PEEK表面制备一层生物活性材料,能够有效改善PEEK材料的成骨功能,但涂层与PEEK基体的界面结合力弱仍是涂层改性亟须解决的问题。例如HAHN等通过气冷喷涂的方式在PEEK材料表面制备羟基磷灰石(HA)涂层,尽管提高了材料的生物活性,但HA涂层与PEEK基体间结合强度为14.3 MPa,仅为PEEK材料自身强度的20%左右。表面化学改性通过引入新的基团或者活性因子,可根据器械需求实现药物缓释、抗菌、快速成骨等定制化功能,同时保留PEEK材料本身优异的力学性能。但表面化学改性一方面存在制备流程复杂,难以从实验室进入产业化,另一方面在材料层面引入了新的风险点,相关技术进入临床存在审批瓶颈。复合材料改性通常选用生物相容性已经被充分验证的材料,通过物理混合的方式与PEEK基体进行复合,制造工艺简单,且材料层面不存在技术风险,因此共混改性的PEEK复合材料结合3D打印多孔结构在产业化应用方面具有更大的前景。ZHENG等研究了材料挤出成形3D打印HA/PEEK复合材料支架的骨整合能力,发现孔隙尺寸为600 μm、HA质量分数为20%~40%时,支架的骨整合能力与金标准“钛合金”相当。SUN等在软组织的研究中也发现,在PEEK中添加HA能够加快软组织与PEEK基体的紧密贴附,这对避免术后炎症、积液等并发症有重要意义。
在生物医用PEEK原材料方面,目前国际市场主要被英国Invibio公司占据,在我国药品监督管理局注册的PEEK第Ⅲ类医疗器械中,尚未有使用国产PEEK原材料的产品。国外厂商对植入级PEEK原材料的垄断局面造成了材料价格高昂,制约了国产PEEK高性能医疗器械的发展。国产植入级PEEK材料的发展需重点解决高纯度PEEK生产工艺中对于潜在可沥滤物、重金属残留和生物相容性的生产控制工艺难的问题。系统研究PEEK生产过程中的合成单体、溶剂等潜在可沥滤物对于生物体的安全容限范围,从而建立起我国的植入级PEEK材料生产和评价体系。
2.3 监管发展
目前我国在增材制造PEEK材料骨植入物领域的标准尚未健全。在原材料层面,YY/T 0660《外科植入物用聚醚醚酮(PEEK)聚合物的标准规范》主要对PEEK材料的成分、理化和力学性能进行了规范,在此基础上,团体标准T/CAMDI015−2022《用于医学植入物的增材制造聚醚醚酮(PEEK)材料》对植入物用到的PEEK材料的可沥滤物、重金属残留及与增材制造密切相关的理化指标进行了规范。上述标准初步建立了PEEK骨植入物材料基础方面的规范。《增材制造聚醚醚酮植入物注册审查指导原则(2022年第3号)》针对PEEK材料植入物大类产品提供了研发和注册依据。目前可用于PEEK增材制造的工艺类型为材料挤出成形和粉末床熔融两类,其成形原理和使用的原材料形态有显著区别,因此还需建立针对特定增材制造工艺的材料标准。
在制造层面,我国已初步建立了增材制造领域的标准体系,但相关标准未考虑到用于医疗器械的制造。由于增材制造工艺逐层累加的性质,制造过程中环境粉尘、机械系统杂质等存在被引入器械内部的风险,且增材制造工艺存在批次间一致性不佳的问题,因此须建立针对医疗器械制造的增材制造设备和工艺评价标准,从而确保产品的安全性和批次间性能。
在医疗器械层面的标准规范方面,我们可在材料、制造层面标准逐步完善的同时,根据市场发展需求和趋势,制定针对具体器械类型的技术标准和审评规范,起到标准和产品同步发展甚至引领产品发展的作用。
3 可降解植入物
3.1 研究现状
近年来,3D打印技术从制造以机械支撑功能为主的惰性人工植入物,向制造以再生修复功能为主的可降解植入物发生了重要转变。这一领域正逐渐成为未来的发展方向和国际的主流共识,特别是基于熔融、无溶剂的增材制造策略,结合目前已经在临床上安全使用数十年的金属和医用高分子材料,为构建临床可用的可降解植入物提供了最为便捷和可行的途径。
开展3D打印可降解植入物研究的单位主要包括哈佛大学、密歇根大学、维克森林大学、莱斯大学、昆士兰科技大学、南洋理工大学、新加坡国立大学、西安交通大学、清华大学、上海交通大学、华南理工大学、四川大学、中国人民解放军空军军医大学等,研究内容集中在医用可降解材料的研发与功能改性、植入物结构设计、3D打印新工艺与装备研发、动物实验等“单元技术”的创新。
在金属方面,镁、锌基材料在增材制造中面临金属蒸发和防爆等工程技术瓶颈,且面临降解速率过快的难题,故动物试验和临床的报告较为罕见。铁基可降解金属材料有少量动物试验报告,NIE等在48周的长期动物试验中验证了铁基可降解金属在承重部位骨骼修复的潜力。
在高分子方面,例如,德国弗劳恩霍夫激光技术研究所筛选了聚乳酸和碳酸钙的复合材料配比,优化了该类复合材料的激光粉末床熔融工艺,成功实现了个性化可降解多孔颅骨板的制造。昆士兰科技大学的研究人员利用生物可降解聚己内酯-磷酸三钙复合材料经熔融挤出3D打印成形了蜂窝状多孔骨植入物,进一步在多孔植入物上负载生长因子,有效促进了绵羊大段胫骨缺损的修复。
目前,3D打印可降解骨科植入物的部分产品已进入临床试验阶段。例如,西安交通大学和空军军医大学合作,2004年实现了3D打印大段可降解人工骨的临床试验。上海交通大学2018年实现了3D打印可降解耳郭软骨植入物的临床试验。3D打印的可降解骨、软骨植入物通常具有和天然骨组织相近的模量,从而可为自体骨组织的再生提供临时的结构和力学支撑。少数单位已成功实现了3D打印可降解骨科植入物的产业应用,如新加坡Osteopore公司将熔融挤出3D打印的聚己内酯支架用于颅颌面骨缺损的修复,与不可降解的惰性植入物相比,可降解植入物大大降低了术后并发症的发生率。
3.2 难点与挑战
针对具有柔软力学性能及复杂生理学功能的心肌、骨骼肌、神经等人体重要功能性组织器官的修复,仍然缺乏相应的可降解植入物设计准则、高精度3D打印工艺装备,以及实现其活性化、功能化再生修复的技术与策略。
在3D打印的可降解植入物与自体软组织力学柔性适配方面,西安交通大学的MENG等 研发了柔性多孔结构的设计与增材制造方法,使聚己内酯支架的弹性模量可在(1944.0±228.7)~(27.3±12.0) kPa广泛调节,覆盖了从软骨到肌肉再到脂肪等软组织的力学需求。该团队进一步提出了柔性可降解乳房支架大变形下的力学性能设计方法,实现了乳房软组织支架植入体内后变形情况的预测,验证了其力学稳定与安全性。2016年,他们与空军军医大学第一附属医院合作实现了3D打印可降解个性化乳房植入物的国际首例临床试验,建立了从患者影像学数据到个性化柔性乳房支架设计、3D打印、临床交付及跟踪的全流程技术体系,颠覆了传统“一刀切,填硅胶”的乳腺肿瘤治疗手段(见图5(a))。经过多年的发展,该团队所研发的可降解植入物已拓展了可降解气管外支架(见图5(b))等临床应用新方向。

图片来源:数字医工坊
在软组织活性化/功能化再生修复方面,当前研究的前沿热点是赋予3D打印可降解支架引导细胞组织发育模拟出自然组织形态和功能的能力。例如,高精度3D打印技术更有利于成形类似自然组织的复杂微观结构,西安交通大学贺健康团队[38]发明了高精度静电3D打印技术,将3D打印的制造分辨率提高到微米甚至纳米尺度。他们利用静电打印技术制造的微米、亚微米纤维支架可有效引导心肌细胞三维的分层定向生长,从而模拟出天然心肌组织的生理结构,为心肌梗死组织的修复治疗提供了新的可能。此外,利用电荷中和与动态电压调控技术,HE等进一步开发了高深宽比微米纤维支架的静电打印技术,实现了世界最高尺寸的微米纤维支架打印,有效引导了骨骼肌细胞大面积的定向生长,为大体积骨骼肌缺损的修复提供了潜在途径。这些研究在功能性软组织的宏观/微观生理结构再生修复方面取得了突破性的进展,未来应进一步融合纳米功能材料或生物活性材料,推动3D打印的可降解植入物向促进组织功能再生的方向发展。
3.3 监管发展
我国3D打印可降解植入物产业方兴未艾,在成果转化方面面临诸多挑战。例如,缺乏相应的测试和评价体系,无法全面和系统地评价3D打印可降解植入物的安全性和有效性,制约了其产业转化。第一,需围绕可降解材料及其3D打印成形过程中可能影响到产品性能的指标进行检测,明确可降解植入物产品加工过程中的潜在风险点。第二,与金属或PEEK植入物的高温加工过程不同,可降解植入物的加工温度普遍较低,难以保证植入物加工过程中的无菌与洁净。需要针对特定的可降解产品制定标准化灭菌工艺规范,确保不损害产品性能的同时保障安全性。第三,在成形质量和有效性验证方面,尚需针对应用需求,明确3D打印可降解植入物的成形精度、力学性能、降解性能及临床有效性的相关定义与测试评价体系。
4 结论
(1)与增材制造金属骨植入物相关的材料和制造技术趋于完善,已进入产业化发展阶段。多孔结构和定制化优势给3D打印骨植入物带来传统技术难以企及的优势,但也给植入物的设计和性能评价带来了挑战。遵循“共性-个性”的脉络,建立共性设计准则和针对各类产品的设计规范是金属3D打印骨植入物未来的发展方向。
(2)增材制造PEEK植入物在人体非主要承力骨的替代物中有突出优势。PEEK材料的生物惰性导致其难以与人体组织形成紧密融合是目前技术研究的重点领域,PEEK基复合材料多孔结构有望为PEEK材料的组织融合难题提供便捷的解决方案。
(3)增材制造可降解植入物有望为各类软硬组织缺损提供个性化、活性化修复的理想途径。围绕增材制造工艺与可降解材料的匹配性、植入物降解与组织再生的匹配性以及植入物长期的安全有效性仍需开展大量实践研究,以推动增材制造可降解植入物的进一步标准化发展与临床应用。
(4)得益于快速发展的增材制造技术和广大的患者群体,我国在增材制造人体植入物领域的研究和应用均处在世界前列,在3D打印骨植入物和可降解软组织植入物等方面诞生了一批具有引领性的临床应用,与之相关的监管科学发展将引领个性化人体植入物从研究走向产业化,有望为我国高端医疗器械行业提供创新发展的重要机遇。
文章来源:数字医工坊
若涉及侵权,请立刻联系删除











