医药和医疗器械生产环境:消毒剂效力验证
2020-09-02
 消毒剂验证 – 上市前的验证
消毒剂验证 – 上市前的验证
用于医药和医疗器械生产环境的消毒剂上市前,需根据相关法规要求进行注册和批准,如美国环境保护署(EPA)、中国卫生相关部门、澳大利亚治疗产品管理局(TGA)、加拿大卫生局及其它机构。消毒剂浓度、处理时间、消毒方法等说明书中的重要内容需进行上市前的验证测试,遵循标准包含WS 628-2018 《消毒产品卫生安全评价技术要求》、2002版《消毒技术规范》、美国AOAC系列消毒剂标准、欧盟EN 13687和EN13704等。
毒剂验证 – 上市后的验证
消毒剂上市后,医药和医疗器械生产企业作为终端用户,应进行消毒剂效力验证(Disinfectant Efficacy Study,DES),不可以不加验证直接使用。消毒剂效力验证需遵循当地GMP规定及环境监测相关标准,在使用环境下进行用户端的消毒剂效力验证。遵循标准因各国各地域而异:


总结
- 消毒剂验证是法规标准对药品/医疗器械生产企业的要求
- 需预先设定明确的方案,考虑QC部门的工作量
- 考虑外包使用经验丰富的被认可的实验室
- 如有新增环境菌株、新消毒剂、新消毒方法等,需再验证
根据各国GMP和相关环境监测标准的要求,医药和医疗器械生产企业作为消毒剂终端用户,应进行消毒剂效力验证(Disinfectant Efficacy Study,DES),不得未加验证直接使用。消毒剂效力验证需遵循当地GMP规定及相关标准,在使用环境下进行用户端的消毒剂效力验证。
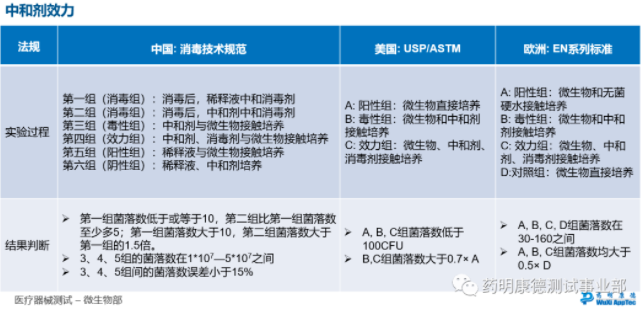
消毒剂验证 – 中和剂试验:中美欧方法对比
消毒剂的效力验证包含(1)中和剂试验以及(2)消毒剂杀菌,通过计算对数下降值(log reduction)来判定是否有效。中和剂实验组数、杀灭实验的菌种选择和对数下降值在不同法规标准中有不同的要求:
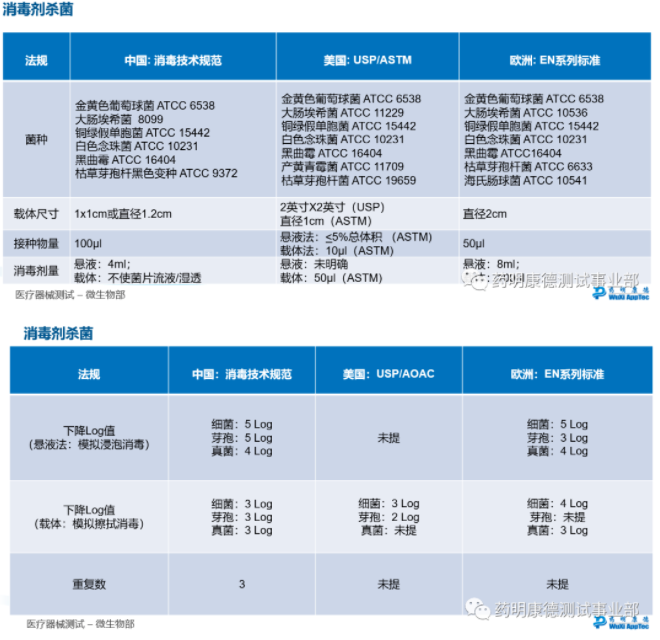
消毒剂验证 – 消毒剂杀菌:中美欧方法对比
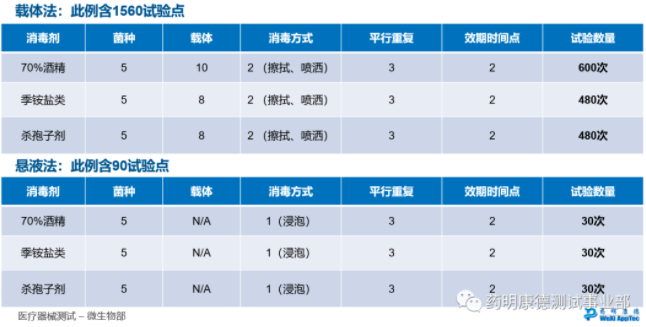
消毒剂验证 – 具体案例
下表是一个药品生产企业消毒剂验证的范例,考虑了多种消毒剂、多种挑战菌株、不同消毒载体(生产厂房中的各类建筑材料),并设计了三次平行重复。显而易见,消毒剂验证动辄包含几百或更多单点实验(下例载体法含1560实验点),工作量大且耗时长,设计方案时需妥善考量各方因素。
总结
消毒剂验证是法规标准对药品/医疗器械生产企业的要求
- 需预先设定明确的方案,考虑QC部门的工作量
- 考虑外包使用经验丰富的被认可的实验室
- 如有新增环境菌株、新消毒剂、新消毒方法等,需再验证











