Medtec中国展浅谈敷料类医疗器械产品技术评审要点
2024-03-14
导语:本文为学习性总结,主要参考审评五部赵艳红《敷料类产品技术审评要求介绍》、《凝胶敷料产品注册审查指导原则》、《液体敷料产品注册技术审查指导原则》、《水胶体敷料产品注册技术审查指导原则》等指导原则,Medtec中国展速递本文,重点从敷料类产品的简介、技术评审关注要点、常见共性问题和临床评价思考等方面介绍,以为诸君在研发过程中提供点滴参考。
本文涉及的产品内容:医疗器械分类目录下的14-09(不可吸收外科敷料 )和14-10(创面敷料)字目录下的产品。目前,二级产品类别大约有14种,敷料产品现状复杂、量大,且涉及面广。目前通过药监局网站搜索相关信息,根据产品关键词,目前国内注册证有1000+张。
目前产品现状:产品广且复杂,产品在属性界定和分类管理面临较大的挑战。对于新产品,缺乏明确的参考依据。在研发过程中,常希望将布料类产品类似于药品,加入活性或药物成分,这导致了属性界定上的复杂性。在药械组合分类中,敷料产品占比较大。此外,由于产品成分多样,这类产品较为复杂。我们常见到原本的二类或三类产品,其成分是我们之前未经历过的。近几年,产品名称更为规范,但早期市场上宣称具备各种功能的产品也很多。在产品功能上,除了传统的敷料屏障功能,企业还希望其产品能促进伤口愈合等多种功能,种类繁多。
监管信息:
(1)命名规范:参考《注输、护理和防护器械通用名称命名指导原则》(微信公众号内 回复 敷料 即可获得敷料导则包)
(2)分类规则
根据2017版《医疗器械分类目录》和《医疗器械分类规则》(微信公众号内回复 分类规则 即可获得),对于医用敷料的分类判定原则如下图所示:
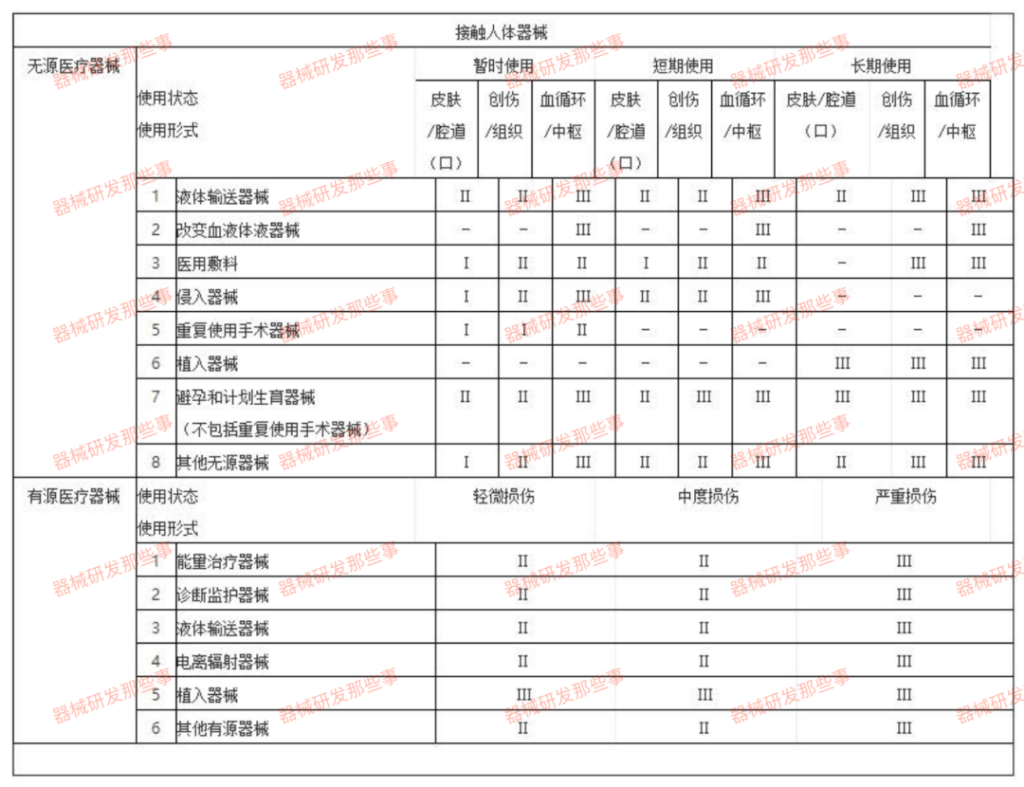
原总局令的第十五号医疗器械分类规则与之前的法规有所区别。在很早之前,长期使用的产品作为三类医疗器械管理,并且根据分类目录,用于慢性伤口的产品作为三类医疗器械管理。分类规则明确规定,如果作为人工皮肤用于慢性创面,全部或者部分被人体吸收,那么须按照三类医疗器械管理。分类目录对真皮深层或者以下组织进行了调整,如果急性创面,那么14子目录下有一个注明仍然按照二类医疗器械管理。无菌产品分类不低于二类。
在真正实施执行过程中,标管中心将用于深II度烫烧烫伤的创面产品仍然作为三类医疗器械管理。如果有新产品进行临床实验,如果做的是浅II,仍然是二类医疗器械。如果适用范围是深II,仍然是三类医疗器械。
同时根据《医疗器械分类规则》中第六条的规定,当医用敷料有以下情形,按照第三类医疗器械管理,包括:预期具有防组织或器官粘连功能,作为人工皮肤,接触真皮深层或其以下组织受损的创面,用于慢性创面,或者可被人体全部或部分吸收的。
Medtec 中国展现场还有更多专注于高端医用敷料的专家、企业负责人,来现场一起探讨认知行业技术发展的前沿,投入资金建立研究体系,开发与市场需求贴合的新型技术和优质产品。点击立刻参展。
如果之前NMPA从未批准过的产品,且加入了新的成分,则建议进行分类界定,并明确属性界定。
(3)注册指导原则或标准
注册指导原则:陆续国家出台了相关的指导原则,具体如下
-
凝胶敷料产品注册审查指导原则(2023年第22号)
-
液体敷料产品注册技术审查指导原则(2023年第22号)
-
水胶体敷料产品注册技术审查指导原则(2020年第31号)
-
重组胶原蛋白创面敷料注册审查指导原则(2023年第16号)
-
外科纱布敷料注册技术审查指导原则(2018年修订)
-
关于《含银敷料注册技术审查指导原则》(征求意见稿)
-
聚氨酯泡沫敷料产品注册技术审查指导原则(2017年第44号)
-
水凝胶敷料注册审查指导原则(征求意见稿)
以上指导原则可在微信公众号内容回复 敷料 获得。在这里不在赘述,值得注意的是《国家食品药品监督管理局办公室关于开展贴敷类医疗器械注册专项检查的通知》(食药监办械〔2013〕34号),虽然目前已失效,但其中的许多内容是值得我们关注的,比如:对仅含有化学成分、中药材(或天然植物)及其提取物等的贴敷类产品,所含成分无论药典是否收载,都必须说明并验证添加此类成分的预期目的和作用机理。这也提示我们产品设计开发中如使用药物,需采用药典收录的药品。同时按照之前撰写的浅谈药械组合产品注册申报资料要求,优先选择已上市药物。
涉及到的相关标准:
如上表所示(微信公众号内回复 敷料 即可获得标准目录),涉及到的标准主要归口为山东省医疗器械和药品包装检验研究院,也可以看出山东检验院在这一方面的实力(你懂我想要表达什么~~)。
第二部分:敷料类产品技术评审关注点
前期撰写过浅谈药械组合产品注册申报资料要求和浅谈无源植介入类医疗器械技术审评关注点,均介绍过121号文件《医疗器械注册申报资料要求及说明》(微信公众号内 回复 注册申报 获得医疗器械注册申报资料要求及说明等9项要求),这里不在一一赘述,注重介绍不同或需要重点关注的事项。
1、综述资料–关于分类界定:
Medtec 中国展了解到如果产品之前从未批过,并且添加了新成分,在这种情况下,审评会要求你进行分类界定。需先明确属性界定。若作为以药品为主的药械组合产品,后续申报资料和研发等方面可能会有不同思路。建议大家首先进行好前期调研。产品描述是为了让审评员清晰地了解产品的具体样式和原材料,以便一目了然地区别于市面同类产品,判断是否为成熟产品,或者有别于已上市产品。
2、技术要求
物理指标:制定参考上图中相关30项标准。
化学指标:对于化学性能,需要考虑以下内容:
-
酸碱度
-
重金属总量 具体元素(根据敷料的原材料、生产加工工艺)
-
灼烧残渣(如藻酸盐敷料)
-
醚中可溶出物(如凡士林纱布)
-
银/抗菌物质含量及动态释放量(如含有银盐的产品)
提供产品性能研究资料以及产品技术要求的研究和编制说明 包括:功能性、安全性指标以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
对于银盐抗菌物质的剂量选择依据和安全阈值分析、释放量和稳定性研究。同时还应研究银/银化合物的存在形式、粒径/尺寸、银含量及分布均匀性、银释放量/释放曲线、抗菌性能要求,并通过体外试验和体内试验,评价产品的抗菌作用机理和有效性。
4、生物学评价
关于生物学评价之前撰写过医疗器械生物学评价路径选择、医疗器械生物学评价的技术评审关注点、医疗器械生物相容性评价和医疗器械生物学评价操作SOP详细介绍过生物学评价,具体步骤可以参考之前的文章进行。这里着重基于敷料类产品具有吸水特性进行差异性介绍。
在评估敷料类产品的生物学性能时,必须考虑到敷料对不同极性和非极性溶剂的吸收差异。这一特性要求在实验设计中进行验证,并在实验方法中明确体现。例如,当开发聚氨酯泡沫敷料时,若仅对中间厚度进行验证,这种方法可能无法充分代表产品的整体性能。实际上,更厚的产品可能会释放更多的化学物质,而中等厚度的验证也可能不具备代表性。因此,在选择样本时需要更加谨慎。
在敷料产品的评估中,我们遵循累积使用时间的原则。根据新版ISO 10993-1的明确说明,敷料在慢性伤口护理中的使用是一个连续更换的过程,而不仅仅是对单片敷料的使用时间。由于许多伤口的愈合时间超过一个月,因此在进行生物学实验时,需要考虑更多的实验项目。尽管有些产品设计时认为产品的单片使用时间不超过一个月,但实际上并未充分评估相关的生物相容性风险。累积使用时间超过一个月的情况下,产品的生物相容性风险会增加。
在亚慢性毒性试验中,样品的剂量选择、接触途径和接触时间需要综合考虑。应当首先考虑临床上的最大使用剂量和接触途径,然后评估时间是否能充分说明产品的亚慢性毒性。有些直接按照动物体重选择剂量,但这种方法忽略了人与动物在剂量换算上的差异。由于人体内个体差异较大,而动物相对均一,因此在大多数情况下,需要对动物剂量进行放大处理。放大的原则,CMDE回复如下:
对于试验中出现统计学差异的评价指标,试验报告需明确相关差异是否有生物学意义并提供理由、分析判断相关差异与受试产品的关系,而非仅简单列出具有统计学差异的项目。另外,对于通过植入方式接触受试品的亚慢性毒性试验,需提供植入剂量的确定依据,如,在动物可耐受情况下,推荐样本植入剂量为拟用人体临床剂量的50~100倍。
https://www.cmde.org.cn/splt/ltgxwt/20180913154300403.html
此外,亚慢性毒性试验的接触途径应模拟实际使用情况,避免选择单一的皮下植入或一次性植入等方式,因为敷料的使用是一个反复接触的过程。正确的时间选择对于亚慢性毒性试验结果的分析评价至关重要。
5、动物试验
常规产品能力和普通适用范围仅限于屏障保护功能,不需要动物实验。若有抗菌或促进伤口愈合的功能,则需选择动物实验。有些企业采用动物实验中兔子较多,还有一些企业做大鼠模型。大家可以参考文献,由于大鼠和兔子的皮肤结构与人差异较大,伤口愈合无法反映真实情况。因此,建议大家选择猪类动物进行伤口模型研发,这样对研发和最终申报有利。
第三部分:敷料类产品CMDE常见共性问题
1、水胶体敷料临床豁免情况不包括哪些?
对应《医疗器械分类目录》(2017年第104号)中14-10-05中举例水胶体敷料或水胶体敷贴。豁免情况不包括:
(1)适应症宣称可以促进上皮化、引导组织再生、促进伤口愈合、减轻疼痛、抗菌、防感染、抗病毒、止血、溶解坏死组织、减少疤痕、防粘连、作为人工皮/皮肤替代物等作用的产品;
(2)宣称可以用于体内伤口、三度烧伤、感染创面、坏死组织较多的创面、发生创面脓毒症的患者等情况的产品;
(3)含有活性成分的产品:如药品/药用活性成分、生物制品/生物活性成分、银、消毒剂等;
(4)其他新型产品,如新材料、新作用机理、新功能的产品。CMDE审评五部
2、聚氨酯泡沫敷料应提交哪些临床评价资料?
对于符合《免于进行临床试验的医疗器械目录(修订)》条件的聚氨酯泡沫敷料,申请人提交申报产品相关信息与目录所述内容的对比资料,以及申报产品与目录中已获准境内注册医疗器械的对比说明和相应支持性资料。
对于不在豁免目录范围内的聚氨酯泡沫敷料,应在满足注册法规要求的前提下,按照《医疗器械临床评价技术指导原则》选择适宜的同品种产品的临床数据进行临床评价并按照该指导原则要求出具临床评价报告。申请人也可以通过临床试验来确认产品临床应用的安全有效性,若开展临床试验,应考虑临床试验目的、研究人群、对照组选择(如需要)、样本量估计、评价指标评估方法和量化方法、统计分析方法等内容。CMDE审评五部
3、负压伤口治疗设备申报注册,配套使用的储液罐能否和治疗设备放在同一个注册单元?配合使用的泡沫敷料能否和治疗设备放在同一个注册单元?
参照《医疗器械注册单元划分指导原则》,有源医疗器械附件与连接使用的主机原则上作为同一个注册单元申报。储液罐不单独作为医疗器械管理,建议和治疗设备作为同一个注册单元申报。
参照《医疗器械注册单元划分指导原则》,与有源医疗器械配合/组合使用的无源类耗材原则上与该有源医疗器械划分为不同的注册单元。配合使用的泡沫敷料为无源耗材类医疗器械,应和治疗设备划分为不同的注册单元申报。
CMDE审评一部
4、有粘胶背衬的聚氨酯泡沫敷料是否符合免于进行临床评价的第三类医疗器械目录中的“聚氨酯泡沫敷料”?
有粘胶背衬的 聚氨酯泡沫敷料 被收录在《免于临床评价医疗器械目录》内。需要注意的是,豁免临床评价不包括以下几种情况:
一、宣称可以促进上皮化、引导组织再生、促进伤口愈合、减轻疼痛、止血、减少疤痕、防粘连等作用的产品;
二、宣称可以用于体内伤口、三度烧伤、感染创面、坏死组织较多的创面、发生创面脓毒症的患者等情况 的产品;
三、含有活性成分的产品:如药品/药用活性成分、生物制品/生物活性成分、银、消毒剂等;
四、其他新型产品。CMDE审评五部
第四部分:敷料类产品临床评价思考
1、敷料临床资料提交的路径主要有三种:
可以参考之前撰写的浅谈医疗器械临床评价路径选择攻略进行选择。
-
免于进行临床试验的产品:符合一定条件的敷料产品可免于临床试验,但仍需提交对比资料和说明。
-
同品种产品临床评价:不符合豁免条件的敷料可通过与已上市的同品种产品进行比较,来论证其安全有效性。
-
开展临床试验研究:对于无法豁免或进行同品种评价的敷料,可开展临床试验。
2、敷料临床试验的基本要求包括
-
明确产品临床作用机理、预期效果、可能风险和不良事件。
-
选择合理的临床试验目的、类型和研究设计,考虑伤口类型和程度等因素。
-
选择已上市且有足够证据证明其治疗有效性的对照产品。
-
根据产品宣称的预期用途选择相应的评价指标,如改善伤口愈合或护理。
-
对临床终点进行评估和量化,确保评估方法统一规范。
3、敷料临床试验的常见问题包括
-
如何选择临床试验的观察终点:应根据创面情况选择适合的观察终点。 -
如何确定临床试验的评价指标:应包括有效性指标和安全性指标,并记录影响因素。 -
如何选择伤口评价方法:考虑伤口的分类、大小和外观影像记录等因素。
结束语:综上本篇论述了敷料类产品的简介、技术评审关注要点、常见共性问题和临床评价思考等方面介绍,其中涵盖了我们在设计开发中的注意事项。同时将本文涉及到的一些实用工具,为便于大家使用,已在干货处蓝色字体标注。挂一漏万,请多包涵!
文章来源:











