2024上海医疗器械创新展Medtec浅谈医疗器械使用期限到可靠性的距离
2024-05-21
1.投诉 术语
3.4 投诉 complaint
宣称已从组织的控制中放行的医疗器械存在与标识、质量、耐用性、可靠性、可用性、安全或性能有关的缺陷或宣称影响这些医疗器械性能的服务存在不足的书面、电子或口头的沟通。
注:”投诉”的此定义不同于GB/T 19000—2016界定的定义。
——《GB/T 42061-2022/ISO 13485:2016》
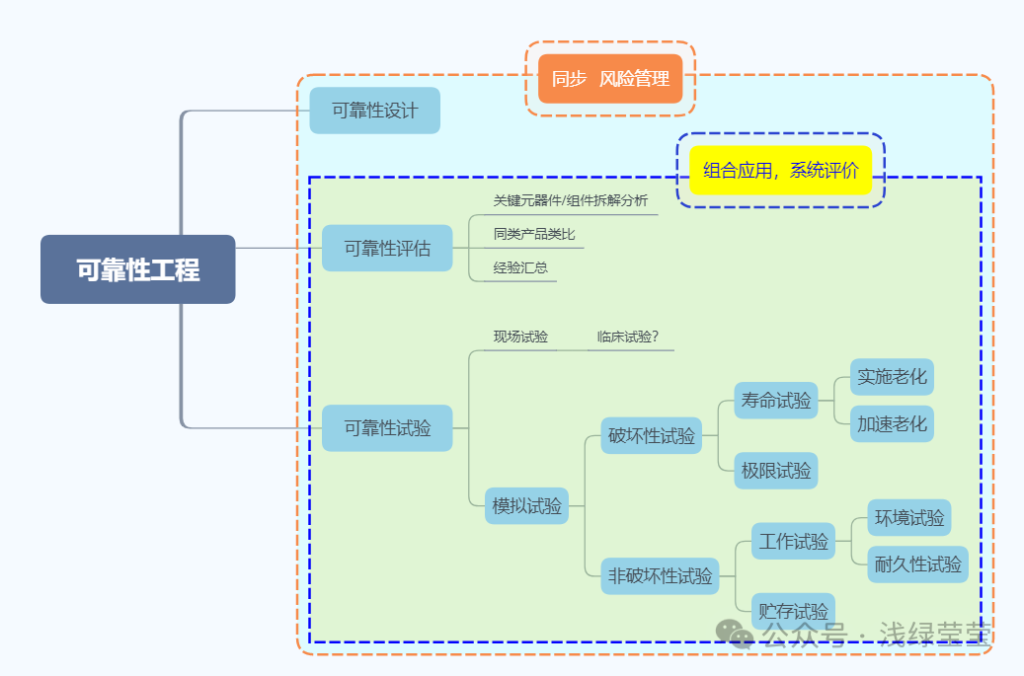
2 、在实操方面关注这个研究的,我这里曾经瞟到过的有:有源植入类起搏器可靠性研究、医用磁共振设备可靠性指标验证方法。我似乎理解为可靠性的设计,是高风险、大型设备研究的“专项”。可是,经专业人士提醒,再回看相关文件,可靠性是产品的基本质量属性。相关摘录如下:
3、《20190514有源医疗器械使用期限注册技术审查指导原则(2019年第23号)》信息摘录:
-
有源医疗器械的使用期限,评价路径分为两种: -
评价路径1:直接对产品进行验证。直接进行产品的实时老化试验或者加速老化试验等。 -
评价路径2:通过将产品(系统)分解为不同子系统/部件的方式进行评价。通过不同的分解方式(如将产品分为关键部件及非关键部件和/或特征部件及非特征部件和/或可更换部件及不可更换部件和/或运动部件及非运动部件和/或电子部件及机械部件等)确定产品的使用期限。
-
-
产品使用期限的具体评估分析方法包括:
-
-
(一)对产品/关键部件使用加速老化试验进行前瞻性研究,和/或用实时老化相关性进行验证;
-
(二)使用本产品或同类产品的经验进行汇总研究,其可能涉及样本的测试、安装使用情况、维修率或维修记录、投诉历史或公开文献的研究等;
-
同类产品或者同类部件应是硬件结构基本一致,材料基本一致,电气性能指标(电压,功率,电流)接近,主要的工艺流程类似,工作环境和临床参考使用强度接近的产品或部件。可通过国内外上市同类产品的使用经验数据分析推断出申报产品的使用期限。 -
(三)对产品/关键部件的可靠性评估分析方法、模拟测试方法或其他理论及仿真计算方法。关键电子部件的使用期限分析可以依据可靠性预计或可靠性仿真等分析方法来评估。
-
以上方法均可以单独或组合采用。也可以采用其他合理、科学的方法。
-
作为临床应用最广泛的医疗器械之一,有源医疗器械在设计时不再只是强调安全性、有效性,更多的也要考虑到患者的舒适性、医生操作的易用性等方面。2024上海医疗器械创新展Medtec将同期举办分论坛4:数字医疗与有源医疗器械安全技术,本次会议将围绕有源医疗器械设计方法、前沿技术及成果展开讨论,同时探讨新趋势下对有源设备电池及检测方法的新要求,及新兴产品技术的应用、未来发展。报名参观>>>
4、《GB∕T 34986-2017 产品加速试验方法》信息摘录:
-
本标准为各种加速试验技术的应用提供指导,用于评估或提高产品的可靠性,发现并减少产品在使用过程中可能出现的潜在故障模式,是确保产品可靠性的有效方式。
-
加速试验方法的目的是在短时间内找出产品潜在的设计薄弱环节,提供产品的可靠性信息,实现产品必要的可靠性/可用性增长。本标准论述可修复与不可修复系统的加速试验。该方法可应用于概率比序贯试验、定时截尾试验以及可靠性增长/改进试验,这些试验测定的可靠性度量值可能与产品失效发生的标准概率值不同。
-
本标准也进一步介绍加速试验或产品筛选方法,该方法用于识别由制造工艺导致的可危害产品可靠性的产品缺陷、产品因制造错误而引入的可能危害其可靠性的缺陷。
理解下来,加速试验,是可靠性评估的有效方法。
5、深究下去,我们会找到 YY/T 1837—2022 《医用电气设备 可靠性通用要求》于2022年5月18日发布,于2023年6月1日起实施。
1范围
-
本文件规定了医用电气设备(以下简称ME设备)和医用电气系统(以下简称ME系统)生命周期内开展可靠性工作的通用要求和基本方法。
-
本文件适用于各类ME设备或ME系统的可靠性工作。本文件不包含专门针对软件可靠性的相关要求和方法。
您看,的确不是高风险植入设备、医用磁共振设备的“专项”。至少说,医用电气设备都要考虑可靠性。从ISO 13485的投诉概念出发,是所有的医疗器械都有可靠性的概念。
6、基于这样的点,我考虑了GB 42062 (替代 YY 0316)医疗器械对风险管理的应用,然后 《YY/T1437-2023 医疗器械 GBT42062应用指南》
4.3 人员能力节选
-
医疗器械风险管理项目的管理;
-
伦理、安全、信息安全和法律责任;
-
风险、风险可接受性和受益风险分析的概念;
-
风险管理和可靠性的概率和统计;
-
设计和开发中的风险管理和可靠性;
-
相关标准和法规; -
风险估计,包括确定伤害严重度和发生概率的方法, -
风险评估的方法学; -
风险控制的方法; -
验证风险控制措施有效性的方法, -
分析生产和生产后信息的方法。
10.3 信息评审 节选
附录G 未使用ISO 14971 设计的组件和器械
由于各种原因,制造商可能没有对医疗器械的每个组成组件遵循GB/T 42062–2022 中所述的所有过程和要求,例如专利组件、软件组件、非医疗来源的子系统,或市场上已有的医疗器械。在这种情况下,证明符合GB/T 42062—2022 时,制造商的风险管理文档可能是有限的和不充分的。然而,在大多数情况下,关于医疗器械及其组成组件的大量信息是可获得的。例如通过评审医疗器械或市场上类似医疗器械的生产后数据可以获得关于实际使用的信息。相关的可靠性和生产数据及以前编制的与安全有关的文件也可能是可获得的。
附 录 H 体外诊断医疗器械指南
7、有源医疗器械 可靠性评估 与 有效期限 研究的关系
-
按试验摸底来分,可分为可靠性鉴定试验、寿命试验、筛选试验、耐久性试验、可靠性增长试验。 -
按试验地点来分,可分为现场试验(工作可靠性的现场测量)和模拟实验(模拟实际工作状态的试验)。 -
按试验项目来分,可分为环境试验、现场使用试验、特殊测检和寿命试验等。