2025上海医疗器械展|无菌医疗器械加速老化试验方案
2025-09-10
XXXXXX加速老化试验方案
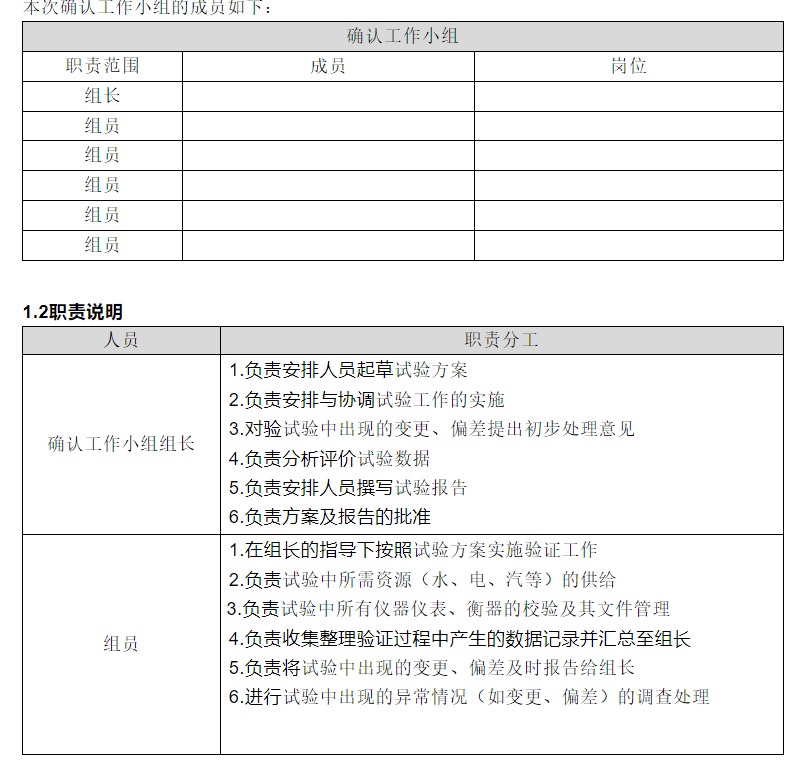
1.人员与职责
1.1确认参与人员
2.概述
本公司生产的XXXXXX属一次性使用的无菌医疗器械,采用纸塑袋进行包装后,通过EO灭菌处理使产品形成无菌的状态,而纸塑袋正是给产品提供了一个无菌屏障,使产品能够在使用地点以无菌的状态进行使用。由于产品性能以及无菌屏障系统有可能会因储存的时间问题导致其相应功能或者无菌屏障的能力衰减或者丧失,最终导致产品在使用时候并非为无菌的状态或非预期性能使用状态,影响产品的安全、有效。因此制定本方案对XXXXX的无菌屏障包装以及产品性能进行加速老化试验,确保产品在一定的储存时间内仍然具备相应的使用性能和屏障功能,保证产品的质量。加速老化试验和实时老化试验同步进行,当出现异常情况时,以实时老化试验结果为准。
3.目的
通过加速老化试验,确认包装在预期的货架寿命内,其无菌屏障和性能均能达到相关的标准要求。
4.范围
适用于本公司生产的XXXXX。
5.依据
《中国药典》2020版
《无菌医疗器械包装试验方法第1部分:加速老化试验指南》YY/T 0681.1
《通过气泡产生法测定柔性包装泄漏的标准试验方法》ASTMD 3078-02(2013)
《染料渗透试验法检验多孔医用包装密封泄漏的标准试验方法》ASTMF1929-15
ASTMF1980 2021 Standard Guide for Accelerated Aging of Sterile Barrier Systems for Medical Devices’
DIN58953-6:2016《消毒-消毒材料供应-第6部分:待灭菌医疗器械包装材料的微生物屏障检验》
ASTM F88/88M-15《软性屏障材料的密封强度的标准试验方法》
GB/T15171《软包装件密封试验测试方法》
YY/T 1750-2020《超声软组织切割止血手术设备》
YY/T 0644-2008《超声外科手术系统基本输出特性的测量和公布》
6.程序
6.1综述
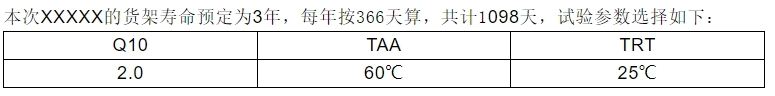
Q10:均相过程温度增减10℃大约造成化学反应速率2倍或1/2倍的变(Q10=2)。
TAA=加速老化温度(℃),TRT=环境温度(℃),AAF(加速老化因子)=Q10(TAA-TRT)/10
RT:要求的真实老化时间,AAT(加速老化时间)=期望储存时间(RT)/加速老化因子(AAF)
加速老化因子(AAF)=Q10(TAA-TRT)/10=2(60-25)/10=11.3137
3年有效期折算加速老化时间(AAT)=3*366/11.3137=98天
有效期3年的加速时间相当老化时间为98天,为确保结果的可靠性,设定加速老化时长为101天(即相当实时时间3年零34天),本次加速老化试验中,在零时刻前进行全面测试后开始老化测试,在加速老化的50天时间节点时,取样品进行检测,若所检测的所有项目均符合相关标准要求,则在加速老化的101天时间节点时,继续取样检测,若加速老化的101天时间测试结果均符合要求,则证明产品的各项性能在3年的有效期内能满足使用要求。如在所有试验期间出现异常情况,则以实时试验结果为准。本次加速老化试验同实时老化试验同步进行。
加速老化时间为101天,分别在0天(加速试验前)、50天、101天的时候对产品进行无菌试验、密封试验测试、染料渗漏试验、琼脂接触攻击试验和密封强度测试以及产品性能测试。

6.2无菌试验
1)仪器:超净工作台、集菌仪、生化培养箱、霉菌培养箱
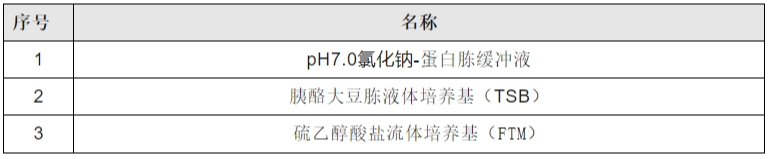
2)培养基和试剂
3)供试液的制备
取样品1件,采用无菌操作撕开一个小口,往小口中加入300ml的pH7.0氯化钠蛋白胨缓冲液,然后使缓冲液充分和产品接触,轻轻振摇3分钟后,将样品中的液体倒至500ml的无菌盐水瓶中,作为供试液。(取3个样品平行操作制备3份供试液)
4)无菌检查—薄膜过滤法
供试品组:取3联集菌培养器按装在集菌仪上,用少量冲洗液过滤润湿滤膜,将制备好的供试液全部转移至培养器内过滤,转速240,过滤完毕后,其中一份加入100ml胰酪大豆胨液体培养基,另外两份加入100ml硫乙醇酸盐流体培养基。
阳性对照:取供试品组中一份含100ml硫乙醇酸盐流体培养基的培养器,在生物安全柜中加入≤100cfu金黄色葡萄球菌。
阴性对照:取2联集菌培养器按装在集菌仪上,用少量冲洗液过滤润湿滤膜,将600ml的冲洗液转移至培养器中过滤,其中一份加入100ml硫乙醇酸盐流体培养基,另外一份加入100ml胰酪大豆胨液体培养基。
5)培养:将上述制备好的培养基,硫乙醇酸盐流体培养基置于30-35℃生化培养箱中培养,胰酪大豆胨液体培养基置于20-25℃中培养,其中供试品组和阴性对照组培养不少于14天,阳性对照组培养≤5天,逐日观察并记录。
6)可接受标准:供试品组和阴性对照组应无菌生长,阳性对照组菌生长良好。
6.3密封试验测试
1)操作:
2)将试样中内装物取出,并将试样内部擦净。将试验液体(与滤纸有明显色差的着色水溶液)倒入试样内,并将口部封好。 将试样在滤纸上放置5min以上,观察试验液体从试样内向外泄漏情况。然后翻转试样,对其另一面进行试验。
3)可接受标准:若无试验液体向外泄漏,则试样合格,否则为不合格。
6.4染色渗透试验
1)试剂:甲苯胺蓝染色液
2)操作:
将3件试验样品和试验液体(水)放置在温度(23+1)℃、相对湿度(50+2)%的试验环境条件下适应48小时。
在塑料面合适位置用刀片割开一道小口,倾斜纸塑袋,使用注射器抽取染色液过小口注射足够的染色液进纸塑袋内热封边缘,通过轻摇纸塑袋使整条热封边缘都覆盖染色液,深约5mm,在10~20s内,观察热封边的浸润情况,确认是否有贯穿整个热封边的试剂通道。另外3条热封边通过旋转纸塑袋使染色液覆盖进行测试。
可接受标准:每条热封边未出现贯穿整个热封边的试剂通道为合格。
6.5微生物屏障性能(琼脂接触试验)
1)操作:
取待检样品5份,裁成边长为50mm的正方形样片,灭菌备用。
将灭菌样品转移至无菌平皿,取107cfu/ml的金黄色葡萄球菌菌悬液5滴均匀滴在样品外表面,互不触碰,在温度19-25℃条件下干燥6-16小时。
将染菌样片的内表面完全平铺于胰酪大豆胨琼脂平板的表面,5-6s后将样片丢弃,将平板于30-35℃培养箱中培养5天,观察细菌生长情况。
阳性对照:参照上述方法取样并接种干燥,将其接种面与胰酪大豆胨琼脂平板接触作为阳性对照,制备一个平皿。
阴性对照:将未接种的样片与胰酪大豆胨琼脂平板接触作为阴性对照,制备一个平皿。
2)可接受标准:
如样品5个胰酪大豆胨琼脂平板上无菌落生长,则表明样品包装材料的抗细菌透过性良好。如在5个胰酪大豆胨琼脂平板上生长的菌落不超过5个,则再取20份样品重复测试。若20个胰酪大豆胨琼脂平板上,生长的菌落仍不超过5个,则此包装材料通过检测。
6.6密封强度测试
1)操作:
将3件样品放于温度(23±1)℃、相对湿度(50±2)%的试验环境条件下适应48小时使其达到稳定状态。
将包装制备成标准规格样片。封口宽度为15mm。每件样品制备5个样片。
将裁剪下来的热封边缘安装在推拉力计上,用一个夹具夹住纸塑袋的塑料面自由端,另一个夹具夹住纸的自由端,选择合适的位置将推拉力计归零(注意归零时推垃力计应处于放松状态),通过将推拉力计上移至受力的临界点,然后开始进行测试操作,,以使产品以200mm/min±10mm/min的速率剥离,记录推拉力计上的峰值作为该测试点的剥离力,并计算最大密封强度。
最大密封强度(N/m)=剥离力×1000/15
2)可接受标准:最大密封强度(N/m)>80
6.7性能测试标准
Aaaaaaa
6.8温湿度记录
试验期间每个工作日对试验箱温湿度进行一次记录。
7.偏差
若在过程中出现异常,相关人员对异常情况进行评审,保留相关异常问题以及评审情况的记录,必要时按《纠正和预防措施控制程序》进行处理。
8.再验证
当包装材料发生改变时需要重新进行验证;
当需要重新定义更长的有效期时需要重新进行验证。

<2025上海医疗器械展>将于2025年9月24-26日在上海世博展览馆1&2号馆举办。现场汇聚近1000家来自全球近27个国家的优质品牌供应商,为中国医疗器械生产厂商提供产品研发、生产、注册所需的设计及软件服务、原材料、精密部件、自动化制造设备、超精加工技术、合同制造、测试和认证、政策法规和市场咨询服务,展品覆盖医疗器械设计与制造全产业链。预登记已开放,点击提前注册即可免费参观,立省百元门票费,现场注册需付费。
文章来源:器械那些事儿
文章内容仅供知识交流分享使用,如涉侵权请联系我们删除。











