生物可降解聚乳酸血管支架有限元分析
2020-10-15
随着现代生活节奏的加快、不节制的饮食以及人口老龄化的加剧,心血管疾病(CardiovascularDisease,CVD)的发病率和死亡率均居各类非传染性疾病之首[1]。目前心血管疾病主要依靠药物和保守治疗,但对于重症患者,需通过手术干预方式进行治疗。随着经皮冠脉成形术(Percutaneous Coronary Intervention,PCI)技术发展,PCI治疗技术已经经历从球囊血管成形术到金属裸支架(BareMetalStent,BMS)、药物涂层支架(Drug-elutingStent,DES)的发展,为人类心血管健康提供了重要保障。但是由于永久性支架长期存在血管中,本身对于血管壁内皮重构有着负面的作用,对于血管的正常收缩舒张亦存在一定的影响,还可能发生原位的血管再狭窄[2-3]。因此,生物可降解支架(BioresorbableVascularScaffold,BVS)的设计理念应运而生,它渐渐地受到了心血管介入医疗器械领域研究者的关注。
目前,在国内外对生物可降解支架的研究中,Igaki-Tamai支架是最早用于人体的生物可降解冠脉支架,主体材料为左旋聚乳酸(Poly-l-lacticAcid,PLLA),2~3年后被完全降解[4]。应用最广泛的当属
ABSORB药物支架,主体材料为PLLA,涂层药物为依维莫司,其厚度为150mm,是球囊扩张式支架,2年以上可完全被降解[5]。ABSORBGT1支架于2016年7月获得美国食品药品监督管理局的上市批准,是第一个在美国投入商业使用的全吸收式生物血管支架。Xinsorb支架是我国自主研制的生物可降解药物洗脱支架,主体材料仍为PLLA,厚度150mm,涂层药物为西罗莫司,是球囊扩张式支架[6-7]。
生物可降解支架上市较少,对支架的有限元研究更少[8-9]。本文基于Abaqus (Dassault Systems Simulia.,Providence,RI,USA)有限元分析软件对生物可降解支架在压握、扩张和疲劳状态下的应力—应变进行模拟分析,同时为支架进行疲劳试验样品的选择提供理论基础。
1 方法
根据临床需求,建立生物可降解冠状动脉血管支架的三维模型,模拟支架从原始尺寸压握进输送器、扩张植入血管的整个过程,研究支架结构在各阶段的应力分布情况,以及支架植入血管后的疲劳安全性能。
1.1 几何模型
通过SolidWorks(SolidWorksCorp.,Concord,MA,USA)三维制图软件建立支架三维几何模型,支架内径×长度:2.5mm×8mm(2508)、3.0mm×18mm(3018)、3.5mm×28mm(3528),壁厚均为150μm,120°周向对称,如图1所示。

1.2 材料模型
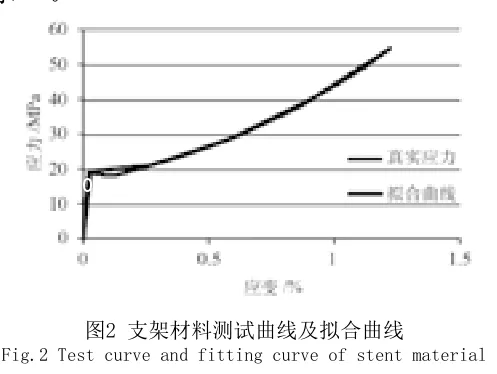
本研究中可降解支架材料为左旋聚乳酸,假设支架材料属性为各向同性,材料模型为非线性的弹塑性模型,如图2所示,弹性模量为674MPa,泊松比为0.3。冠脉血管材料模型为超弹性材料模型[10],不考虑斑块等因素。压握工具和扩张工具用刚性管来表示[11]。
1.3 边界条件
第一步压握,利用一个圆柱形刚性管代替压握工具。支架与刚性工具之间的接触采用面到面接触,支架表面设置自接触,并定义接触属性。对刚性管施加位移载荷,使支架从原始尺寸进行压握,均压握到1.2mm。由于支架结构是120°周向对称,在支架1/3对称面施加对称边界条件。第二步压握后回弹,经上述压握后去除刚性管,让支架自由回弹,来模拟支架的压握回弹过程。第三步扩张,假设球囊对支架在扩张过程的最终变形影响不大,为简化计算,用一个圆柱形刚性管来替代球囊。对代替球囊的刚性管施加位移载荷,使之达到支架扩张的极限内径,让支架随着代替球囊的刚性管从压握回弹状态扩张至极限尺寸。第四步扩张后回弹,去除代替球囊的圆柱形刚性管,模拟支架在扩张状态下自由回弹。第五步模拟疲劳,加入冠脉血管模型进行支架疲劳分析。支架外表面与血管内表面间的接触采用面对面接触,并对血管内表面施加P收缩压=160mmHg和P舒张压=80mmHg(1mmHg=133.32Pa)的交变外载荷。
1.4 网格划分

2 结果与讨论
2.1 应变分析
本研究中三种规格支架在压握的过程中,外径均压到1.20mm,其有限元分析的结果与实际压握的结果形貌一致,3018规格支架等效塑性应变达到1.167mm,如图4(a)所示。支架在扩张的过程中也出现较大的应变,其有限元分析的结果与实际扩张的结果形貌一致,3018规格支架等效塑性应变达到1.816mm,如图4(b)所示。

2.2应力分析
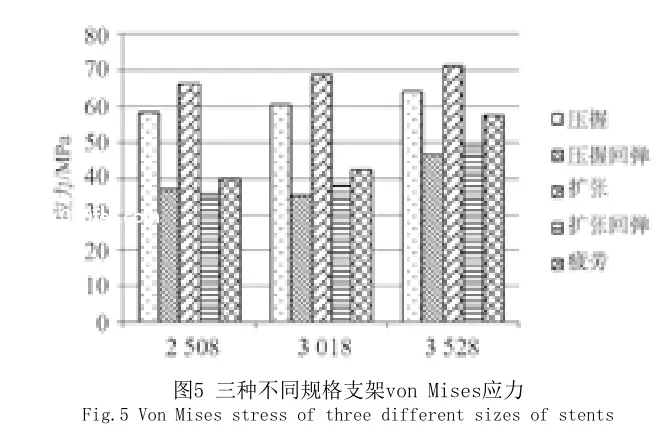
本研究是基于应力的分析,最大拉应力是引起材料断裂的主要原因。支架在变形的过程中主要产生在塑性变形阶段,且支架材料特性已经进入到非线性阶段,因此,在Abaqus分析结果中采用vonMises应力来表征。图5中为2508、3018、3528规格的支架在不同压握、压握回弹、扩张、扩张回弹及疲劳状态下的最大应力值。在模拟过程中,同一规格不同状态的支架,在扩张的过程中会产生最大的拉应力,其次是表现在压握过程中。同一状态不同规格的支架,支架的直径越大,在各阶段产生的应力就相对越大。
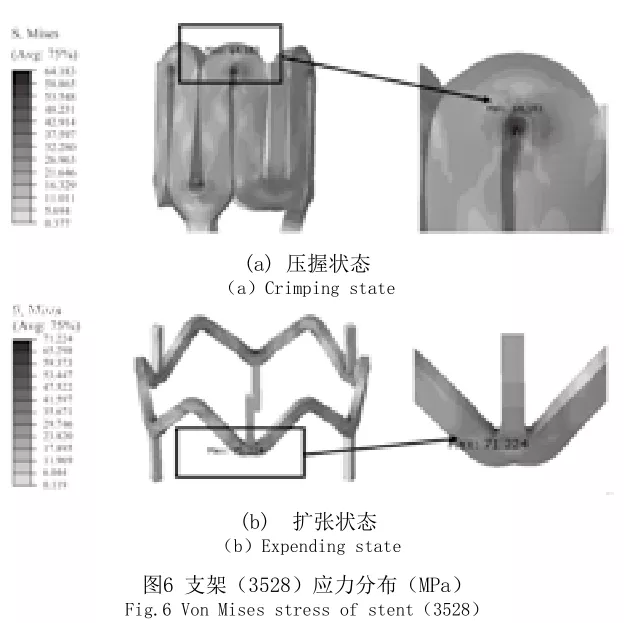
PLLA支架的力学变形主要集中在波段,尤其是在波段的内表面中心位置,波杆和连接杆的应力分布相对均匀。在压握的过程中,支架最大应力主要集中在波段的内表面中心位置,2508、3018和3528规格支架的最大应力分别为58.5MPa、60.7MPa和64.2MPa,如图6(a)所示。在扩张的过程中,支架最大应力主要集中在连接杆与波杆连接弧段内表面,以连接杆为对称面对称表现,2508、3018和3528规格支架的最大应力分别为66.2Mpa、68.8MPa和71.2MPa,如图6(b)所示。
2.3疲劳分析
根据临床状况对支架外表面施加交替变化的外载荷。在疲劳的过程中,支架最大应力也主要集中在波段的内表面中心位置和连接杆与波杆连接弧段内表面,2508、3018和3528规格支架的最大应力分别为40.0MPa、42.6MPa和57.6MPa。
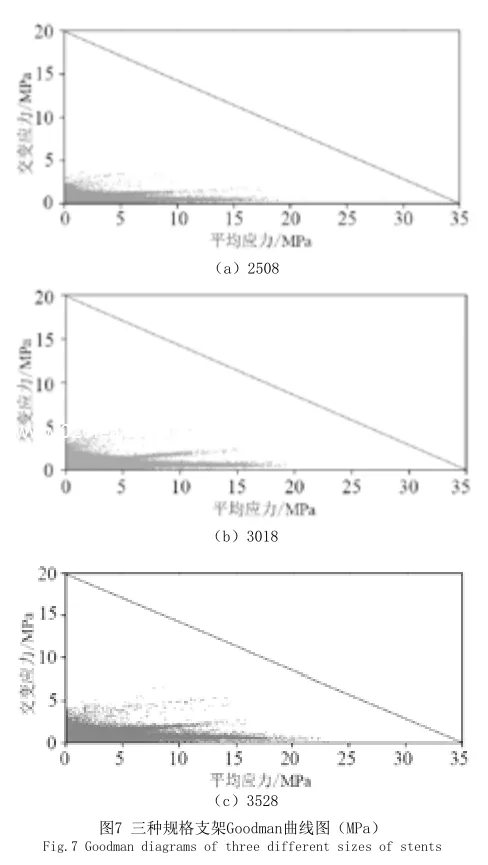
本研究依据Goodman[12-14]准则判断方法对支架的疲劳安全性能进行评判。横坐标为平均应力,纵坐标为交变应力,三种规格支架的Goodman曲线图见图7。2508、3018和3528规格支架的最小安全系数分别为n1、n2和n3。对比三种类型的支架的安全系数:n1>n2>n3,建议使用3528规格的支架做疲劳测试。
在疲劳分析的过程中,PLLA支架经过1900万次的脉动疲劳,将支架放在扫描电镜(ScanningElectronMicroscope,SEM)下分析,我们可以看到支架在波段的内表面中心位置以及在连接杆与波杆连接弧段内表面等位置产生裂纹,进而产生断裂,如图8所示,这与有限元分析的结果相一致[15-16]。对于这些应力集中的地方,其降解往往就在那边发生,并且应力越集中,裂纹就在那边扩展,降解也最先在那边产生[8]。

3 结论
本文通过有限元数值模拟的方法,对生物可降解支架在压握、扩张和疲劳状态下进行模拟分析,研究了三种不同规格的支架在各阶段的应力分布情况,以及支架植入血管后的疲劳安全性能。
支架在压握和扩张过程中,有限元分析的结果与实际压握和扩张的结果形貌一致。在应力分析的过程中,同一规格不同状态(压握、扩张和疲劳)的支架,在扩张的过程中会产生最大的拉应力,其次是表现在压握过程中。同一状态不同规格(2508、3018和3528)的支架,支架的直径越大,在各阶段产生的应力就相对越大,即3528规格支架为最危险规格,为支架的实体疲劳试验选型提供依据。支架有限元分析的结果与疲劳试验时的结果一致,即支架在波段的内表面中心位置以及在连接杆与波杆连接弧段内表面等这些上述应力集中的位置产生裂纹,并可能发生断裂。
本文在研究的过程中,也存在一定的不足:比如材料没有考虑温度的影响,模拟血管没有考虑斑块的影响,对于PLLA这类特殊材料没有考虑降解对它的影响等,在后续的研究中,我们将会将上述问题考虑进去并解决。
图文来源:中国医疗器械杂志











