《心血管植入物 心脏封堵器》标准解析 | 医疗自动化制造设备展植入介入研发制造工程师必看
2023-04-07
医疗自动化制造设备展Medtec China 2023了解到标准规定了关于封堵器的预期性能、设计属性、材料、设计评价、制造、灭菌、包装和制造商提供信息等方面应遵循的具体要求。本文主要对针对标准的适用范围、材料和设计评价部分的一些关键测试项目中需注意的问题进行分析和解释,以期标准实施后各方能够更深入地理解标准中的相关内容。
1.标准适用范围
目前已上市的封堵器材料组成主要包括镍钛合金编织丝、不锈钢套和高分子材料阻流膜。对于金属材料的属性评估主要包括材料化学成分、显微结构、镍钛合金的相变温度(Af)及生物相容性等[3]。其中,镍钛合金材料的化学成分和显微结构可参考GB 24627-2009《医疗器械和外科植入物用镍- 钛形状记忆合金加工材》标准中规定的要求和试验方法。不锈钢材料的化学成分和显微组织可参考GB 4234.1-2017《外科植入物 金属材料 第1 部分:锻造不锈钢》标准中规定的要求和试验方法。镍钛合金的相变温度可参考YY/T 0641-2008《热分析法测量NiTi 合金相变温度的标准方法》中标准试验方法。针对封堵器组成中的高分子材料评估主要是红外光谱的定性鉴别等。关于生物相容性可依据GB/T 16886.1系列标准进行评价。
表1 是标准设计评价部分有关封堵器(含输送系统)的一些关键性能指标,下面将逐一阐述这些指标的具体检测方法以及测试样品的选择建议。
不溶性微粒进入人体后,其粒径超过一定大小或数量超过一定限度,可能造成人体的炎症或栓塞等不良反应。因此,标准规定封堵器应在最小微粒污染条件下生产,并应对产品的微粒水平进行评估。但标准中未给出具体测试方法,目前针对微粒的测试建议参考以下两种方式:一是参考《中华人民共和国药典》2020 版(0903 不溶性微粒检查法)对微粒的大小和数量要求,必要时进行微粒成分分析;二是参考YY/T 1556-2017《医用输液输血注射器具微粒污染检验方法》[4]对封堵器及输送系统的总体污染指数进行规定。另外,企业在进行该项评估时,也可以结合模拟使用,对模拟产品推送、释放、回撤整个过程中微粒的脱落情况分别进行评估。
金属腐蚀除了对器械本身性能产生不良影响以外,腐蚀产物的释放对人体也会产生有害的生物反应。封堵器结构组成中通常包含镍钛合金和不锈钢两种金属材料,尽管已有证据表明两种材料具有良好的耐腐蚀性,但器械的设计、加工、表明处理等都会影响最终产品腐蚀敏感性[5,6]。因此,标准要求应在实际或模拟生理环境下进行该项目评估。对于成品器械目前主要参考行标YY/T 0695-2008《小型植入器械腐蚀敏感性的循环动电位极化标准测试方法》,且待测样品通常应为经过完整处理达到临床要求的产品[7]。
阻流性是评估封堵器植入后的即时血流封堵效果。通常,封堵器通过致密金属网或阻流膜来实现其阻流性。封堵器产品中的阻流膜一般选用聚酯材料或聚四氟乙烯材料制造。阻流膜厚度和孔隙率会直接影响到封堵器植入后的即时封堵效果,因此,阻流膜厚度或孔隙率可间接地反映出阻流膜的阻流性能。孔隙率可参照YY 0500-2021《心血管植入物血管假体 管状血管移植物和血管补片》标准中给出的三种测试方法。
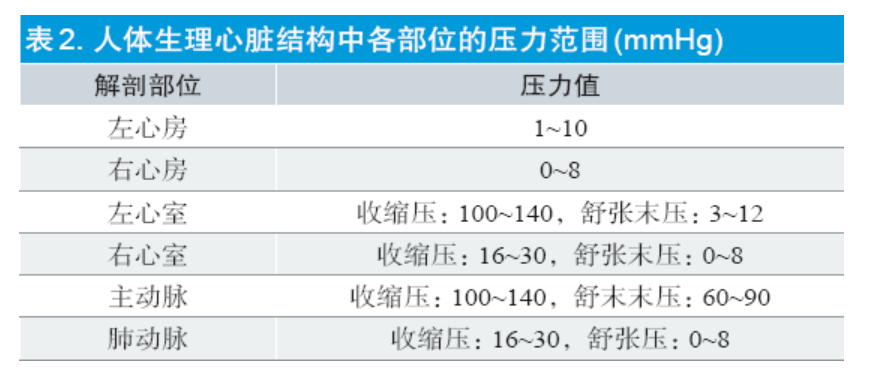
标准建议可通过在模拟人体生理环境下,采用模拟血液或与血液黏度相似的试验液体进行阻流性能相关试验。对于不同类型的封堵器可参考不同应用部位人体生理压差条件(详见表2)[8]。图1 给出了一种可供参考的阻流性能试验装置示意简图。
该项目用于评估封堵器在磁共振环境下的安全性和兼容性,具体试验方法可参照YY/T 0987 系列标准。封堵器注册单元中包含几十种型号规格,针对如何选择最恶劣规格型号作为典型性测试样品,建议从以下方面进行考虑:①对于磁致位移力试验和磁致扭矩试验,应选用含铁、镍等铁磁性金属占比最大的型号规格作为最恶劣测试构型。②对于射频致热试验,YY/T 0987.4-2016 标准8.4 章节和附录A.1中给出了详细地选型所遵循的原则[9]。对于封堵器这类非实体类型产品,该标准建议通过电磁和热仿真工具(如:Sim4life软件)先建立仿真模型,再计算E 场、B场、SAR 值和/ 或产品表面的温度分布,从而估算出产品植入人体后的最大温升位置,并最终确定最恶劣的规格型号[9]。③封堵器产品的伪影过大会影响临床医生对植入产品周围的病变判断。伪影试验应选用几何尺寸最大的型号规格作为最恶劣测试构型。
医疗自动化制造设备展Medtec China 2023 16大特色展区,包括医用3D打印,骨科加工专区,及超精密激光加工、金属材料,部件和加工设备等研发设计领域,许多展商也将来到展会现场展示企业最新的产品及设计。点击快速预登记。
应力/ 应变分析的目的是测定封堵器内部由于制造、释放和体内载荷形成的临界应力和/ 或应变,并用来评估产品设计是否有合适的安全余量。对于封堵器的应力/ 应变分析可参照YY/T 0859-2011《均匀径向载荷下金属血管支架有限元分析方法指南》中的方法进行。可参考以下步骤:①明确分析步骤:明确完整的分析步骤,封堵器产品的分析应至少包括封堵器生产加工、压握进输送系统中以及释放到预期使用部位的全部过程。②几何模型:封堵器的几何模型(所有型号规格)应根据其生产加工工艺确定,并通过拉伸—卸载试验确定其材料力学属性;同时,应建立封堵器植入部位的人体组织模型(如心脏房/ 室隔膜),并根据临床条件确定其形状、硬度、厚度及顺应性等属性信息。③边界条件及约束条件设定:应针对封堵器生产加工、压握进输送系统中以及释放到预期使用部位建立边界条件和约束条件。④疲劳分析:在疲劳分析时,心脏收缩和舒张对封堵器的影响,可通过对封堵器两侧盘面施加交替变化的压力差模拟出来。对于体内的应力/应变分析应测定其极限平均应力/应变及循环应力/ 应变。⑤分析结果:根据材料的疲劳特性来解释分析结果,材料和/ 或样品的疲劳测试可以用来测定这些疲劳特性及设计安全余量。
通过应力/ 应变计算结果可确定出各个规格型号封堵器的安全余量,并选出最恶劣的规格型号用于真实的疲劳试验验证。
疲劳试验主要评价封堵器长期植入后的保持功能性和结构完整性的能力。该标准中规定了体外疲劳试验周期至少3.8 亿次(相当于10 年)。
疲劳试验的关键问题在于测试样品规格型号的选择应能代表每种失效模式下最有可能发生失效的规格型号,并应建立应力/ 应变分析的基础之上。封堵器疲劳试验方法也可分为生理压力测试方法和位移控制测试方法。
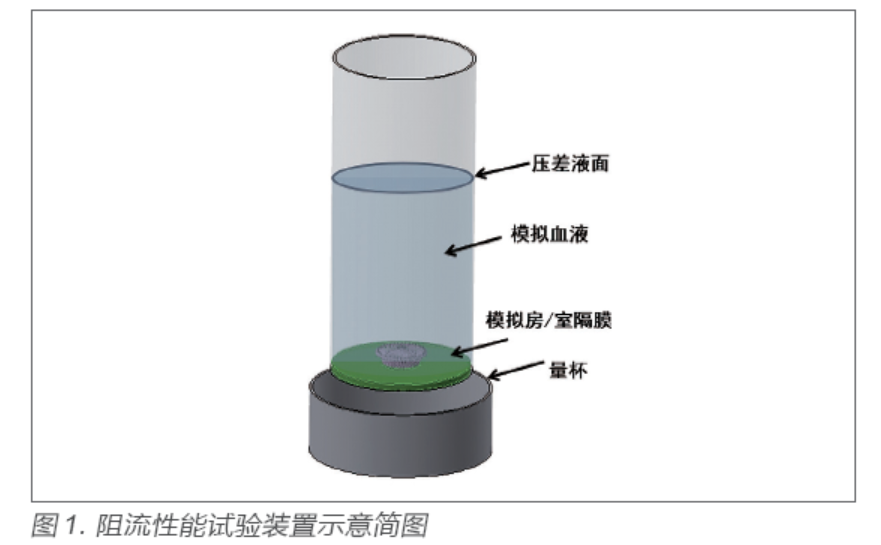
生理压力测试方法的试验原理是类似人工心脏瓣膜疲劳试验一样,通过模拟封堵器植入预期部位后其两侧的压力差变化,使封堵器完成周期性运动来评估其疲劳耐久性能。生理压力测试方法的测试设备如图2 所示。
疲劳试验中模拟房/ 室隔膜的材料属性应尽量与人类自体房/ 室隔膜相似。在疲劳试验中,封堵器两侧的压力差值的设置不应低于表2中给出的参考压力差。疲劳试验的测试频率可根据封堵器的实际响应情况进行设置,应保证封堵器在每个脉动周期均实现完整运动过程;试验溶液应选择与血液具有相似的等渗盐溶液,如磷酸盐缓冲液;试验温度宜与生理温度保持一致。在整个疲劳试验中,应保证封堵器两侧的压力差不低于预期压差值。在完成3.8 亿次循环周期后,观察封堵器是否出现潜在的失效模式。
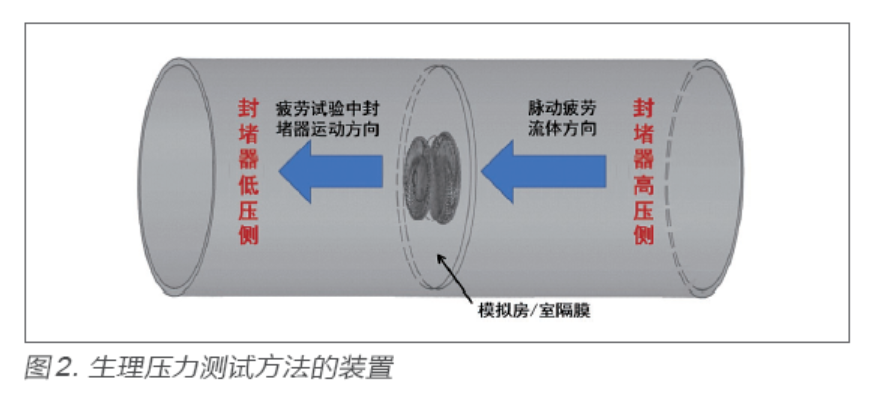
位移控制测试方法是对封堵器施加周期性单侧压力的一种疲劳试验方法,位移控制测试设备如图3 所示。
位移控制测试方法的关键在于疲劳试验中位移量的设置。位移量可通过以下方法确定:①通过医学影像学方式测量封堵器在人体内的位移量;②通过有限元分析仿真建模,分析计算出封堵器在生理条件下的位移量;③通过体外模拟试验,利用脉动设备在1.2Hz情况下,对封堵器施加预期压力差值,并测量出其上标记点的位移量。关于周期性单侧压力条件下封堵器的疲劳试验的具体方法,YY/T 1553-2017标准附录A.5.1.6 已给出,本文不再赘述。
全球高值医用耗材市场规模成长迅速,医用材料及部件受下游应用市场需求增长,或将迎来市场元年, 医疗自动化制造设备展Medtec China 2023特设材料,部件和加工设备专区,品类范围包括原材料、成型材料、转接器、刀片、夹紧用品、管接头和连接件、紧固件、垫片/圈、量规,测量仪表,计数器、铰链和插销、嵌件、封堵物、光学部件、移液器、密封件等,目前已有路博润、塞拉尼斯、迈图、奥美凯、Acme Monaco、Pulse、Wytech、韦恩堡、田中贵、罗信、康德莱等代表性企业实力加盟。
医疗器械与人体接触后的许多生理反应与器械中存在溶出物或渗出物有关。因此,标准要求对于含有医用高分子材料的封堵器及输送系统宜进行化学性能评价。化学性能试验方法目前主要参考GB/T 14233.1-2008《医用输液、输血、注射器具检验方法 第1 部分:化学分析方法》。由于封堵器为长期植入物,输送系统为短期介入器械,建议在浸提液制备时分开规定,封堵器参考GB/T 14233.1-2008 标准表1 中序号9,而输送系统可参考GB/T 14233.1-2008 标准表1 中序号2 或序号7 进行。
此外,大量的研究数据表明,封堵器等镍合金器械植入后易引起的中枢性循环疾病、过敏反应、感染风险等不良情况,可能与镍离子析出有直接关系[10]。因此,生产企业也应关注镍离子的体外析出风险,从而确保产品的临床使用安全性。
该项测试的目的是使用模拟预期植入环境的模型来评估封堵器系统的使用性能。表3列出了应考虑的与封堵器模拟使用试验相关的三个最关键性能指标、潜在失效模式、失效对器械的影响及潜在的临床风险[1-3]。
封堵器系统的模拟使用测试的关键是解剖模型的确定,因此,选择解剖模型时宜考虑到封堵器输送到预期植入部位的输送路径的直径、成角、迂曲及血管顺应性等参数。图4给出了封堵器系统的模拟使用模型。

本文主要针对YY/T 1553-2017 标准中一些关键性能指标的试验方法进行了解读。除上述性能指标外,标准在设计评价部分还包括尺寸、拉伸强度、稳固性能等许多其他重要评价指标。YY/T 1553-2017 标准的实施后,国内外相关封堵器生产企业可参照该标准的相关要求,结合自身产品的设计特性,制定其产品技术要求,监管部门也将该标准作为封堵器产品安全有效性的重要评价依据。
文章来源:











