医疗器械博览会为你总结医疗器械设计输入的法规要求
2023-08-09
医疗器械设计的输入必须来自标准。“输入”一词似乎更高。无论是哪种系统标准,它都有这个词。事实上,它被简单地理解为需要考虑的因素,或者设计该产品需要收集的信息和情报。
法规的要求
QSR820
820.3(f) Design input means the physical and performance requirements of a device that areused as a basis for device design. 设计输入是作为器械设计基础的对器械实体和性能的要求。
820.30(c)Design input 设计输入
Each manufacturer shall establish andmaintain procedures to ensure that the design requirements relating to a deviceare appropriate and address the intended use of the device, including the needsof the user and patient. 制造商应建立和维护程序以确保与器械相关的设计要求是事宜的,并且反映了包括使用者和患者需求的预期用途。
The procedures shall include a mechanismfor addressing incomplete, ambiguous, or conflicting requirements. 程序应包括处理不完整,不清晰和互相矛盾要求的机制。
The design input requirements shall bedocumented and shall be reviewed and approved by a designated individual(s).The approval, including the date and signature of the individual(s) approvingthe requirements, shall be documented.设计输入要求应形成文件,并由指定人员评审和批准。包括批准日期和批准人签名的批准信息应形成文件。
ISO13485
7.3.3 Design and development inputs 设计和开发输入
Inputs relating to product requirements shall be determinedand records maintained (see 4.2.5). These inputs shall include: 产品需求的输入应被决定并记录。这些输入应包括:
a)functional, performance, usability and safety requirements, according to theintended use; 根据预期用途确定的功能,性能,可用性和安全需求
b)applicable regulatory requirements and standards;适用的法规和标准要求
c)applicable output(s) of risk management;适用的风险管理的输出
d)asappropriate, information derived from previous similar designs;来源于以前类似设计的信息
e) other requirements essential for design and development of the product and processes.产品和过程的设计和开发所必须的其他要求
These inputs shall be reviewed for adequacy and approved.设计和开发输入应被充分评审并批准。
Requirements shall be complete, unambiguous, able to be verified or validated, and not in conflict with each other. 需求应是完整的,清楚的,能够被验证或确认,并且不相互冲突的。
China GMP 第三十条
设计和开发输入应当包括预期用途规定的功能、性能和安全要求、法规要求、风险管理控制措施和其他要求。对设计和开发输入应当进行评审并得到批准,保持相关记录。
法规的解析
共同点
设计和开发输入应被识别,记录,评审,并批准;
设计和开发输入应包括产品的预期用途,及功能、性能和安全要求、法规要求、风险管理控制措施和其他要求。
差异点
QSR820/ISO13485明确需求应完整的,清楚的,不相互矛盾的。ISO13485中同时明确需求是能够被验证或确认的。China GMP 中没有相关要求说明。
ISO13485/ChinaGMP明确指出风险管理与设计输入的关联,风险控制措施是设计输入的一部分,QSR820 中没有明确说明。
医疗器械博览会着眼有源医疗装备,开辟Medtec高端医疗设备设计与制造服务专区,涵盖电子部件、电机&传动控制,芯片传感,连接器线束,电源电机和光学组件等展品。点击快速加入医疗器械博览会。
设计开发输入
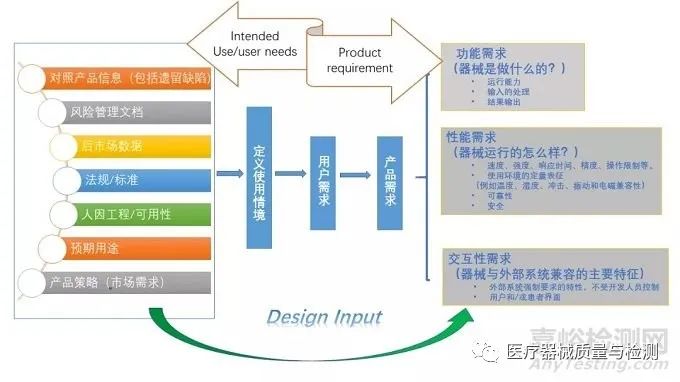
设计开发的输入定义得到是从产品预期用途到产品的需求。如何确定设计开发输入应考虑包括市场策略,预期使用情景,人因工程,可用性,适用的法规标准,对照品的产品信息如后市场数据(遗留的产品缺陷,投诉,不良事件等),评审各个因素并确定产品需求包括各种不同类型的需求如功能性需求,性能需求及交互性需求。然后再对产品需求进行分解至子系统需求。
医疗器械博览会意识到,医疗器械外观设计的输入也应包括外观的输入。外观的输入实际上是比较同类产品、类似产品或相关产品的外观。这些不是必要地输入信息,但对于产品外观设计而言,不可避免地要参考同类产品的外观。
文章来源:












