高端医疗设备展速递医疗电子最新设计:局部应用于皮肤伤口的mRNA纳米传感器
2022-06-21
有效的伤口管理策略需要在整个愈合过程中准确评估伤口状态。这可以通过检查包括蛋白质、DNA和RNA在内的分子生物标志物来实现。有效的术后伤口管理对于防止潜在的并发症如手术部位感染(SSI)和伤口裂开(SWD)非常重要。术后伤口管理的关键原则包括及时的伤口评估、适宜的伤口清洗和敷料使用、以及伤口并发症的早期识别和积极治疗。然而,现有的用于量化这些生物标志物的方法,例如免疫组织化学和定量聚合酶链反应,通常是费力的、资源密集的和破坏性的。
高端医疗设备展Medtec中国近年来不断聚焦医用电子领域,传感器变得更加便携,在家庭保健领域以及各种应用场景创造无限可能。近期,香港城市大学生物医学工程系徐臣杰教授和韩国大学医学院Woo Young Jang团队报道了局部应用于皮肤伤口的mRNA纳米传感器(即纳米闪光)的开发和利用,以通过皮肤细胞中mRNA生物标志物的靶向和半定量检测来揭示愈合状态。在2D和3D体外模型中,这些纳米传感器在揭示伤口发展不同阶段的mRNA生物标志物的动态变化方面的功效和效率得到了证明。在小鼠模型中,该平台允许通过伤口愈合指数实时跟踪和识别伤口愈合阶段以及正常和糖尿病伤口愈合过程。
上述研究成果在《Advanced Science》上在线发表,题为“Monitoring Wound Healing with Topically Applied Optical Nano Flare mRNA Nanosensors”。南洋理工大学化学与生物医学工程学院Jangsun Hwang为论文的第一作者,香港城市大学生物医学工程系徐臣杰教授和韩国大学医学院Woo Young Jang,为论文共同通讯作者。
图1:纳米传感器示意图
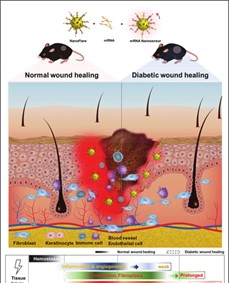
纳米传感器(即NFs)检测细胞mRNA以监测伤口状态的图示
图2:成纤维细胞(NDF)、角质形成细胞(HaCaT)和内皮细胞(HUVEC)生物标志物的筛选
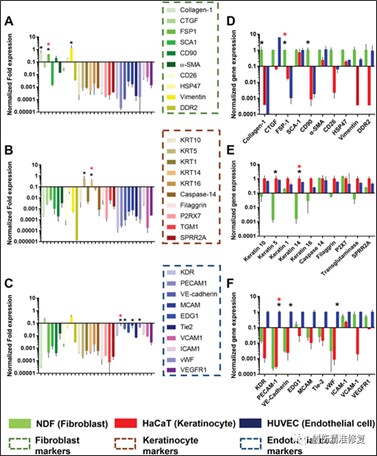
(A、D)在30种潜在的生物标志物中,正常成纤维细胞(NDFs)强烈表达成纤维细胞特异性蛋白1 (FSP1)、胶原1和分化簇90(CD90) mRNA。FSP1在角质形成细胞(HaCaT)和内皮细胞(HUVEC)中的表达较低。因此,作者选择FSP1作为成纤维细胞的生物标志物。(B、E)角质形成细胞(HaCaT)显示角蛋白5 (KRT5)和角蛋白14 (KRT14) mRNA的强表达。KRT14在表皮角质形成细胞的基底层中特异性表达,并经常在角质形成细胞驱动的再上皮化中用作生物标志物。在这里,作者选择KRT14作为伤口愈合中角质细胞的生物标志物。(C、F)内皮细胞(HUVEC)表现出血小板和内皮细胞粘附分子1(PECAM1)(即CD31)、激酶插入域受体(KDR)、VE-钙粘蛋白和血管性血友病因子(vWF)的更高表达。PECAM1调节白细胞迁移和炎症、血管反应,还涉及包括血管生成、凋亡、血小板聚集和血栓形成在内的生物功能因此,PECAM1作为内皮细胞的生物标志物。
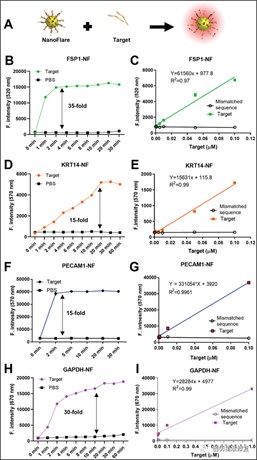
(A)实验图解:NF由13 nm金纳米颗粒(GNP)核心和周围的核酸双链体组成。双链体包含识别序列(称为R)和flare序列(称为F)。(B、C) FSP1-NFs与靶序列相遇时,荧光强度发生了超过35倍的变化。在0.001-0.1 μm范围内,荧光信号与目标序列的浓度呈线性相关。(D-I)KRT14-NFs获得了类似的结果。同时,PECAM1-NFs和GAPDH-NFs也显示了更好的灵敏度,目标响应度在0.0001和0.1 μm之间,相关性良好。所有的NFs都显示出令人满意的选择性、监测窗口和特异性。
高端医疗设备展Medtec中国技术论坛“高端有源医疗设备核心部件与技术论坛”将一次性内镜图像传感器CMOS技术详解,同时再现场展商也将带来前沿的传感器产品,从各类医疗泵到生命体征监测,从微创医疗到呼吸管理与改善。点击快速预登记,来Medtec中国展现场了解更多关于传感器的前沿技术与解决方案。
图4:通过NFs和qPCR评估和确认生长因子刺激下的靶基因表达
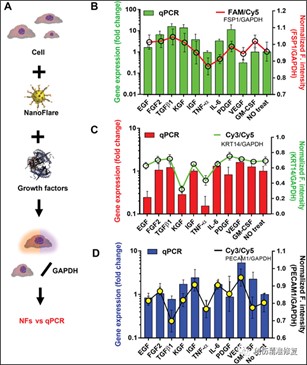
(A)生长因子对这三种类型细胞的刺激作用的能力插图。(B)在成纤维细胞(NDF)中,转化生长因子-β(TGFβ1) (8%)、碱性成纤维细胞生长因子2(FGF2) (7%)、角质形成细胞生长因子(KGF) (7%)、血小板衍生生长因子(PDGF) (3%)、粒细胞巨噬细胞集落刺激因子(GM-CSF) (7%)和上表皮生长因素(EGF) (5%)增加了FSP1的表达,而胰岛素样生长因子(IGF)和血管内皮生长因子(VEGF)没有诱导显著的变化。相反,TNF-α和IL-6分别降低了10%和4%的FSP1表达。qPCR分析证实了这些结果。(C)在角质形成细胞 (HaCaT) 中,qPCR 分析显示,在用FGF2、TGFβ1、IGF 和GM-CSF处理后,KRT14 的表达没有变化。然而,IL-6 略微增加了KRT14的表达,而EGF(0.24倍)、KGF(0.28倍)和TNF-I(0.15倍)下调了KRT14的表达。qPCR和NF结果高度一致。(D)在内皮细胞(HUVEC)中,PECAM1-NF 的荧光信号在FGF2、IGF、IL-6和VEGF处理后增加,而 TGFβ1、TNF-α和GM-CSF下调PECAM1信号。qPCR证实了这些结果。
图5:3D和2D细胞培养物的共焦荧光图像
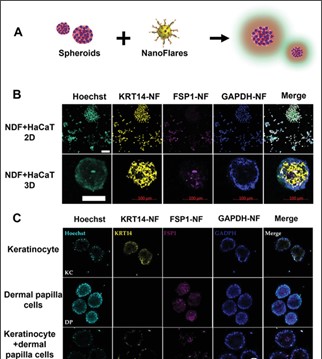
(A)实验说明示意图;(B) 2D和NDF和HaCaT与NFs的3D共培养:两种模型中引入的 NF 都可以成功识别特定细胞中的靶基因。(C) 在KC-(人表皮角质形成细胞)和 KCDP-( KC和DP的共培养)球体中检测到 KRT14-NF信号,而在DP(人真皮乳头细胞)和KCDP球体中观察到FSP1 信号。作者注意到,虽然在所有细胞中都检测到GAPDH-NF的荧光信号,但KRT14-NF和FSP1-NF的荧光信号在 KCDP 共培养球体中没有重叠。所有这些发现表明,NFs 有效地渗透到 3D 球体内的细胞中,并以高特异性标记细胞。
小结
高端医疗设备展Medtec中国也希望各位医械工作者可以得到一些设计研发的新思路。本文主要总结了一些局部应用的mRNA纳米传感器(即NFs)的开发和利用,并通过靶向和量化皮肤细胞中的mRNA生物标志物来揭示伤口状态。在2D和3D体外和体内模型中证明了NF在揭示伤口发展的不同阶段的mRNA生物标志物的动态变化方面的功效和效率。在小鼠模型中,该平台允许FWI实时跟踪和识别伤口愈合阶段以及正常和糖尿病伤口愈合过程。在未来,作者计划使用手持式荧光显微镜重复这种方法,并将其应用于临床。此外,除了手术伤口,将在未来的研究中进行烧伤伤口的探索。
来源:创伤精准修复











