质量管理
-
2024.11.18
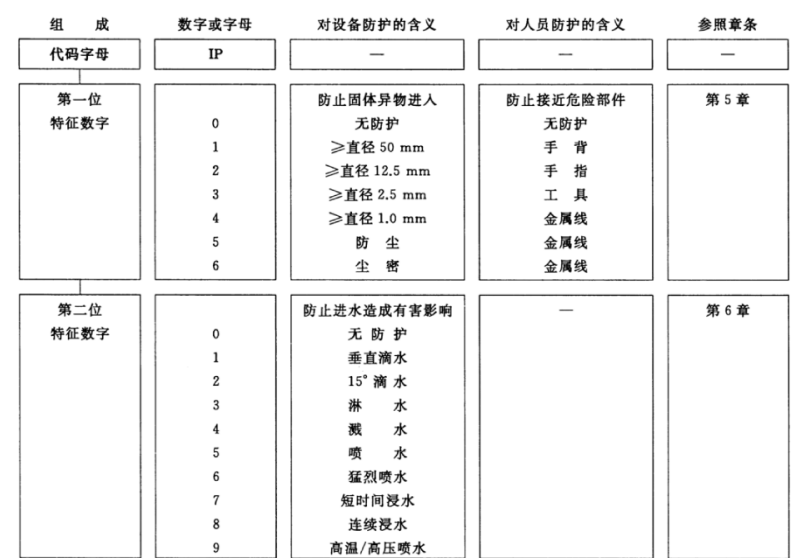
2024有源医疗器械创新论坛震惊!原来医疗器械里有那么多分类!
阅读更多 -
2024.11.14
有源医疗设备展谈医疗器械工艺用水验证

阅读更多 -
2024.11.06
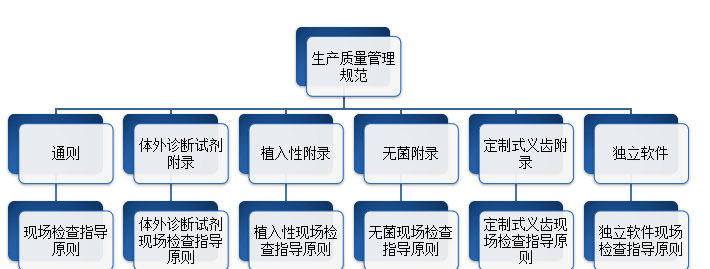
2025上海医疗器械创新展谈中国GMP医疗器械生产质量管理规范包含哪些?
阅读更多 -
2024.11.05
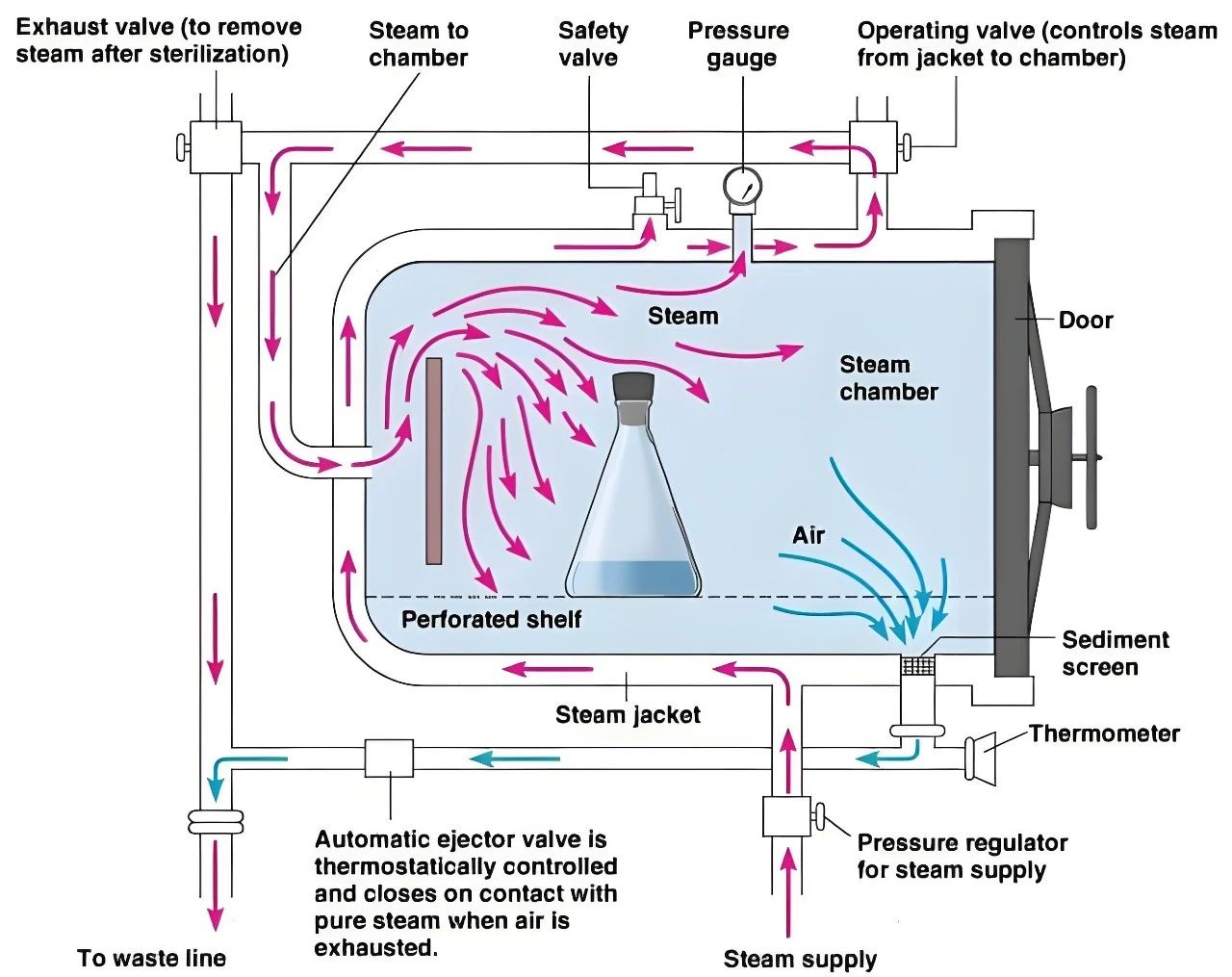
有源医疗设备展谈论:你真的了解高压蒸汽灭菌器吗?
阅读更多 -
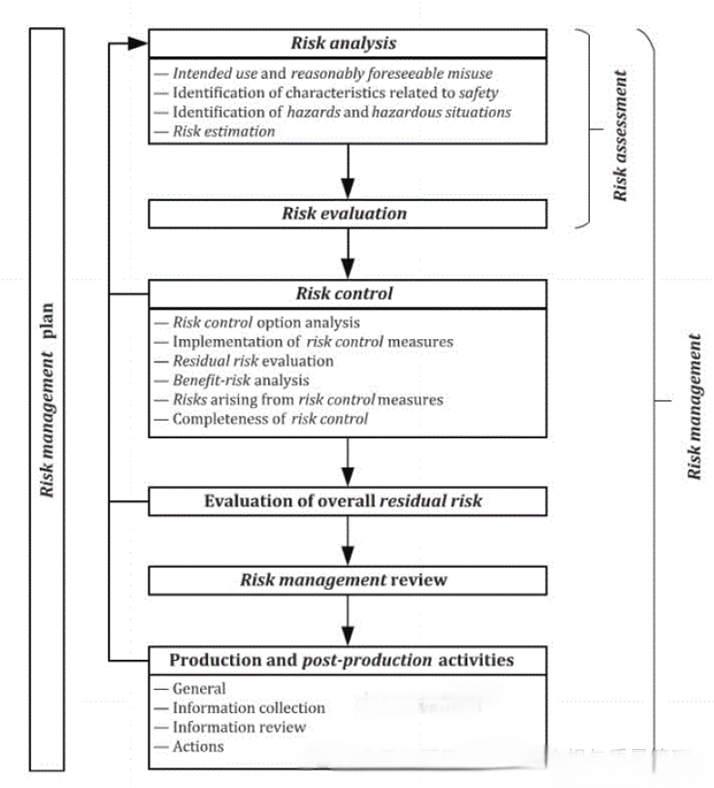
2024有源医疗器械创新论坛谈:ISO13485和GB/T42061解读、导入与审核(条款7.3.3 设计和开发输入)
阅读更多 -
2024.11.04
2025上海高端医疗设备展验证与确认:医疗器械领域的深入解析与实例
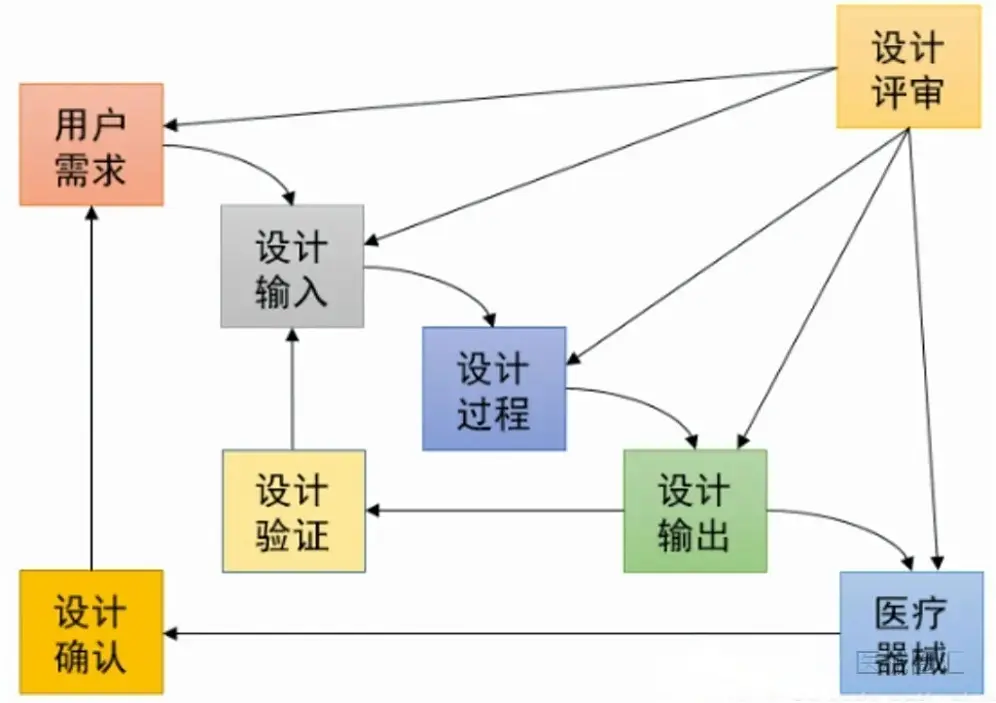
阅读更多 -
有源医疗设备展解读高压灭菌锅(压力蒸汽灭菌器)的灭菌效果监测怎么做?
阅读更多 -
2024.11.02
有源医疗设备展解读医疗器械EMC要求概览 1
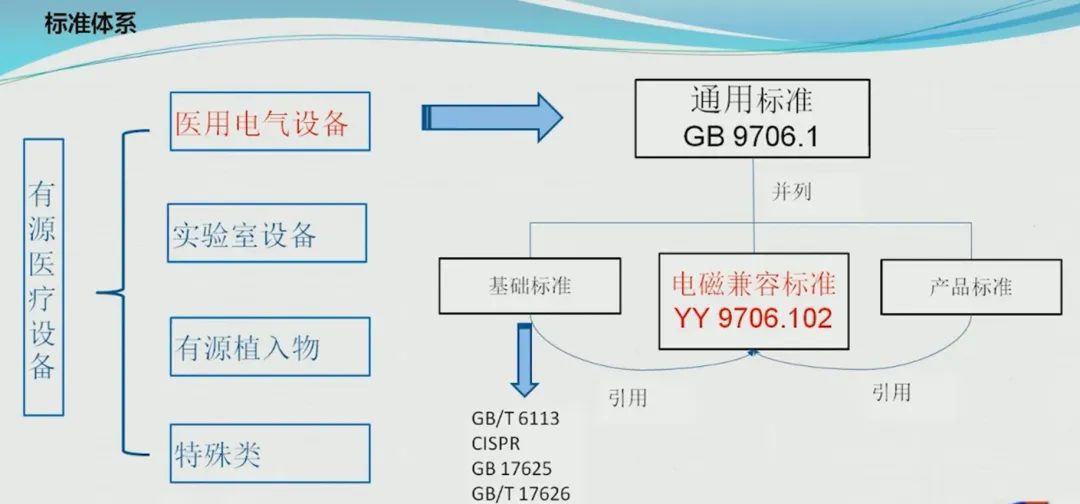
阅读更多 -
2024.10.31
2025上海医疗器械创新展解读:无菌 l 除菌过滤器的压力监测

阅读更多 -
2024.10.30
2025上海医疗器械创新展谈ECA:关于欧盟无菌附录1的问答
阅读更多











