美国FDA关于自测用血糖监测系统的研究要求探讨
2019-05-22
糖尿病是当前威胁全球人类健康的最重要的非感染性疾病之一。随着我国人口老龄化与生活方式的变化,糖尿病患病率从1980年的0.67%飙升至2013年的10.4%。我国可能已成为世界上糖尿病患病人数最多的国家,糖尿病流行形势非常严峻[1,2]。血糖监测系统一般是指通过检测血液中葡萄糖浓度来辅助诊断和治疗糖尿病的医疗器械。
美国FDA于2016 年底发布了2 个血糖监测系统的上市前申报资料要求指南,分别为自测用血糖监测系统(Selfmonitoring Blood Glucose Test Systems,SMBGs)和专业血糖监测系统(Blood Glucose Monitoring Systems,BGMSs)[3,4]。
FDA针对这两种血糖监测系统分别制定指南,主要是由于两种系统的预期使用环境和使用人群不同,所以在研究资料要求上也有所区别。
自测用血糖监测系统(SMBG)是预期提供给非专业人员,作为Over-the-Counter(OTC)非处方家用监测血糖水平的测试系统。其检测对象为非专业医疗人员,检测样本一般为指尖或其他部位的毛细管全血,且不能用于测量新生儿(出生未满28d)的血糖浓度。其分类依据参照21 CFR 862.1345的“血糖检测系统”,产品代码为NBW。在我国,根据《体外诊断试剂注册管理办法》将此类产品作为第二类医疗器械管理。
总体来说,由于自测用血糖监测系统预期使用人群为非专业人员,其年龄、灵活性、视力、理解力等因素都会影响器械的使用和判读结果,所以自测类系统应针对使用人群复杂性的特点,对产品进行全面的评价。本文着重从以下几个方面对其中自测用血糖检测系统(SMBG)的技术研究要点进行探讨。
1.分析性能指标
目前我国的血糖类产品执行的标准为《GB-T 19634-2005 体外诊断检验系统 自测用血糖监测系统通用技术条件》,其主要依据ISO 15197-2003转化而来。ISO 15197在2013年进行修订,提高了对血糖系统的性能要求[5]。美国FDA在2016 年发布的关于血糖监测系统的新指南,其具体要求较之ISO 15197-2013 又有所提高。下面从精密度、线性、方法学比较、干扰性能等方面,针对FDA本次指南的新要求,对自测血糖系统的性能要求进行阐述。
1.1 精密度
精密度是指在某种条件下多次测量同一样本结果的一致程度,例如批内精密度和中间精密度等。应选取人静脉全血样本进行研究,可以使用经过糖化或稀释的血样,以覆盖全部声称的血糖测量范围。研究批内精密度时,可采用不同血糖仪和多个血糖试纸批次重复测量同一样本,例如使用至少来自3 个批次、10 盒的500 个血糖试纸,选取5 个浓度,每种样本浓度均应使用至少10 台血糖仪,每台至少测量10次。中间精密度的研究可采用多个试剂系统批次进行多日测量,例如使用至少来自3 个批次、10 盒的500 个血糖试纸,每种样本浓度均应使用至少10 台血糖仪,至少持续10d,每天对每种血糖浓度区间的1 份样本进行至少1 次测量。因此,每种血糖浓度至少共得到100 个测量值。总之,应对可能影响检测精密度的主要变量进行验证,除检测试剂本身的影响外,应对不同仪器、操作者、地点、精密度评价周期等要素进行相关的验证。
1.2 线性
应使用含有不同浓度葡萄糖的人体血液样本,浓度应尽量在线性范围内均匀分布,分析至少11 个浓度水平,进行线性范围的研究。
1.3 方法学比较/用户性能
该研究主要是通过对比血糖监测系统的血糖测量值与对照方法的血糖值,对系统准确度及用户性能进行评价。在该项研究中,对于不同的部位(例如前臂、手掌等)都应采用至少350 名受试者的样本进行检测,并参照使用对照方法测量的样本对结果进行评价。检测的样本应充分覆盖声明测量范围,应至少包含10 份血糖浓度 (80mg/dL和10 份血糖浓度) 250mg/dL的原始样本。
入选的受试者应包含该器械的新用户和老用户。至少10%的受试者应为新用户,并包括非糖尿病患者。研究前,应该评估血糖监测系统的说明书或标签的易读性。由于预期人群为非专业人员,所以说明书的阅读等级应为8 年级的水平或更低。建议使用Flesch-Kincaid、SMOG或相当的计算机程序对标签的易读性进行评估。应测定并记录每名研究参与者的红细胞压积值。
在方法学比对研究中,准确度的要求为:95%的结果应该在对照结果的±15%的范围内,或者99%的结果应该在对照结果的±20%的范围内。器械的检测范围应至少覆盖50~400mg/dL的血糖浓度。
1.4 干扰研究
干扰性研究旨在评价外源性物质产生的交叉反应和内源性物质等对测量结果的影响程度。另外,红细胞压积对结果也有一定的影响。
该项评价应在血糖浓度为50~70mg/dL、110~130mg/dL和225~270mg/dL这三个医学决定水平进行,对每种潜在干扰物进行评价,记录下出现干扰时的最低浓度。已知的潜在干扰物质列表见表1。
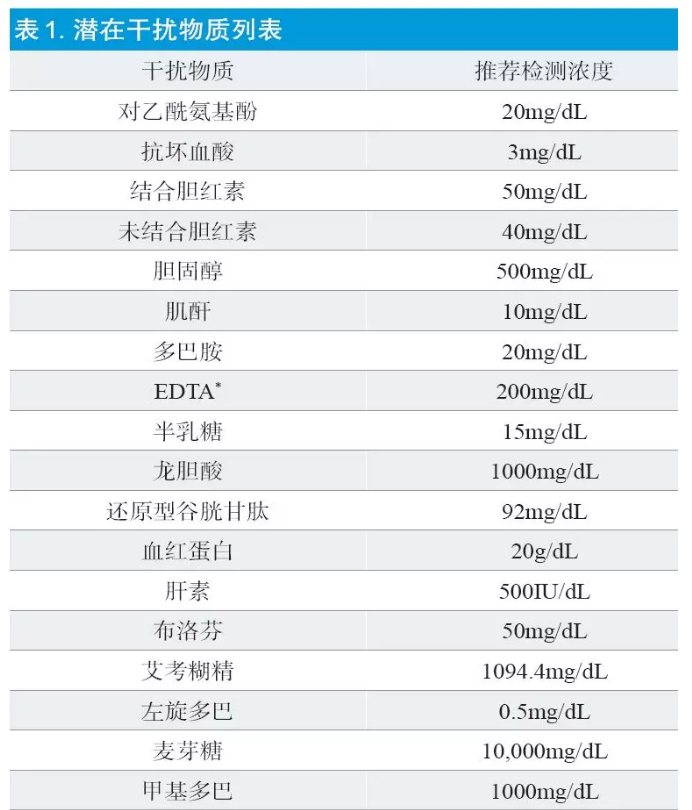
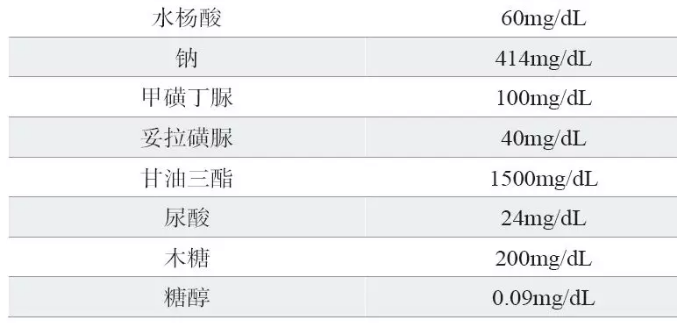
红细胞压积水平可能对结果产生分析误差,因此应评价红细胞压积对器械性能的影响。由于预期使用人群的大多数红细胞压积水平在20%~60%,因此建议将20%~60%的红细胞压积作为器械的声明检测范围,并且器械应至少能准确测量在30%~55%红细胞压积范围内的血糖。应选择不同红细胞压积水平,采用多批血糖试纸进行试验,红细胞压积造成的误差结果在血糖浓度≥75mg/dL时,偏倚平均值应低于8%,单个数值的偏倚值不得高于对照方法的15%。
2.稳定性
稳定性研究资料主要包括:①实时稳定性研究,据此明确存储条件及有效期;②开瓶稳定性研究,将血糖试纸在声称的开瓶有效期内打开和封闭,在不同的温湿度条件下,研究其储存条件和有效期;③延长开瓶稳定性研究,将血糖试纸在声称的开瓶有效期内完全打开,在不同的温湿度条件下,研究其储存条件和有效期。进行稳定性研究时,应在不同的时间点对精密度和准确度进行充分的评价。
3.环境试验
应研究不同温度、湿度和海拔高度条件,对检测结果的影响,以考察血糖监测系统在不同操作条件下的性能表现。
4.清洁/消毒
产品的预期用途应该明确说明供非专业人员家用,且仅供单名用户使用。采血笔仅限单名患者使用,不得共用。产品的所有外表面应能够进行清洁和消毒。由于预期用途为家用,所以消毒方法应便于家用。清洁和消毒过程都需要单独的验证程序和质量标准,并在说明书或标签中应包含清晰详细的说明。
应对配合器械使用的消毒剂的有效性进行验证,消毒剂产品应能有效杀灭获得性免疫缺陷病毒(HIV)、乙型肝炎病毒和丙型肝炎病毒等。清洁和消毒程序应不会使器械性能退化或改变,例如在进行多个消毒周期后,器械的准确度和精密度等不受影响。在风险分析资料中应包括关于清洁和消毒程序的评估。
5.其他
其他还包括对样本用量、校准和质控、软件、机械振动试验、冲击试验、电气安全性能等的研究要求,这些要求相对来说比较基本,属于器械的一般通用要求,且两种血糖监测系统间并无太大的区别,故在此不一一详述。
6.结语
糖尿病已成为世界范围内威胁人类健康的头号杀手之一,血糖监测系统预期用于糖尿病的辅助诊断、治疗和病情监测,其作用非常重要[6]。FDA关于自测用血糖监测系统的技术要求非常严格,且针对其预期用途(非专业人员、非专业医疗机构使用)的特点制定了特殊的要求,以便对该系统进行更加科学可靠的控制。我国相关行业工作人员应不断调整思路,根据该类自测用产品的特性对产品进行全面的研究和评价,从而获得更佳的安全有效性。
来源:中国医疗器械信息











