法规政策
-
2019.03.14
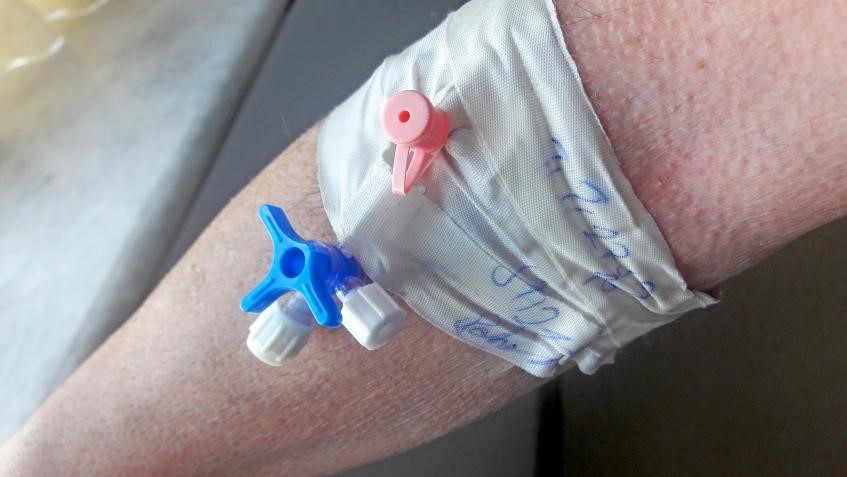
ISO 80369: 常见问题解答
以下是关于开发和测试小口径连接器的一些常见问题的解答。
阅读更多 -
2019.03.13
关于欧盟MDR你必须知道的8件事
在最近一项关于欧盟新法规的问卷调查中,调查参与者的回答让人不禁对推出该项法规的时机是否成熟表示担忧。你准备好了吗?

阅读更多 -
2019.03.07
2019“医疗器械注册人制度”大提速!这场“解绑”变革,距离真正颠覆还有多远?
近期,国务院一则批复——“开展医疗器械注册人制度试点,允许北京市医疗器械注册人委托京津冀地区医疗器械生产企业生产医疗器械”,引起了业内广泛关注。
阅读更多 -
2019.02.28
我国医疗器械上市许可持有人制度的构建与完善(上)
2017年10月8日,中共中央办公厅和国务院办公厅联合印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出要总结药品上市许可持有人制度试点经验,加强药品医疗器械
阅读更多 -
我国医疗器械上市许可持有人制度的构建与完善(下)
构建医疗器械上市许可持有人制度并非是一时的洞见和创意,而是有着长远的构建背景和设计过程。 2013年8月30日,第十二届全国人大常委会第四次会议通过了《全国人民代表大会常务
阅读更多 -
2019.02.25
国外医疗器械注册审评项目管理人制度研究及启示
span style=”font-weight:normal;”>2017年,中共中央办公厅和国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,其中要求完善医疗器械注册审评项目管理人制度。笔者比较了美国、欧盟审评机构对项目管理的组织结构设计,验证了不同组织结构对我国审评机构的适用性,认为以专业为导向、兼顾效率的组织结构更加适用于我国。
阅读更多 -
更新生物相容性测试方法的另一个理由:欧盟新医疗器械法规
本文中化学和生物相容性领域的专家Matthew Jorgensen博士分享了在医疗器械生物相容性方面的最新见解和预测。

阅读更多 -
2019.02.22
终于搞懂生物相容性标准 ISO 10993-1:2018
span style=”font-weight:normal;”>新版生物相容性标准ISO10993-1:2018,特别是大家所熟知的生物相容测试参考清单附录A的整体更新,以及附录B生物风险管理整体引入ISO TR 15499的更新等,将对医疗器械生产商、注册人及各检验机构产生结构性的影响。
阅读更多 -
2019.02.19
浅析医疗器械独立软件描述文档编制要点
《医疗器械软件注册技术审查指导原则》要求独立软件应提供软件描述文档,文章将对独立软件在软件描述文档编制中的要点进行浅析。
阅读更多 -
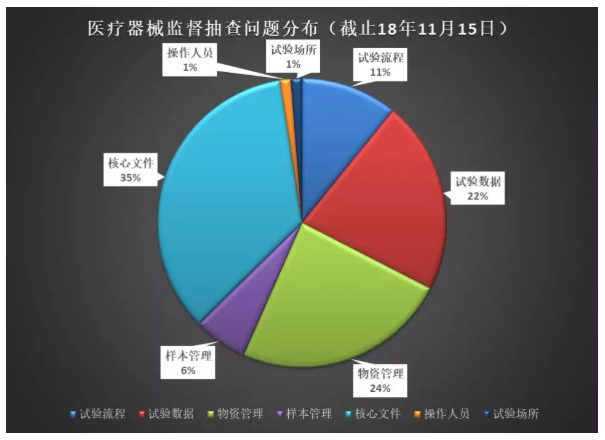
器械临床试验核查问题分析及常见问题汇总
2019年已经正式拉开帷幕,回想过去的一年,我司接受了某省局、国家局对于临床试验两次监督抽查,小编与队友们回忆往昔,以切身经验为基础,对2016年至今2018年总局三年内的医疗器械临床抽检公告进行了总结。
阅读更多











