法规政策
-
2020.03.20
国家药监局:发布《医疗器械注册质量管理体系核查指南》
为加强医疗器械产品注册工作的监督和指导,进一步提高医疗器械注册质量管理体系核查工作质量,国家药品监督管理局组织制定了医疗器械注册质量管理体系核查指南(见附件),现予发布。

阅读更多 -
2020.03.19
新冠疫情全球爆发,FDA、欧盟纷纷推迟国外检查,立即生效!
近日,FDA和EDQM均发布了暂停国外检查的通知,如下:
阅读更多 -
新冠疫情全球爆发,FDA、欧盟纷纷推迟国外检查,立即生效!
近日,FDA和EDQM均发布了暂停国外检查的通知

阅读更多 -
2020.03.18
重复性使用医用防护服标准制修订项目获批立项
3月13日,国家药品监督管理局下发通知,批准《重复性使用医用防护服》医疗器械行业标准制修订项目应急立项。

阅读更多 -
2020.03.15
长三角医疗器械注册人制度跨区域监管办法发布
为规范医疗器械注册人跨区域委托生产的监督管理,推进长江三角洲区域医疗器械跨区域监管,特制定《长江三角洲区域医疗器械注册人制度跨区域监管办法(试行)》

阅读更多 -
2020.03.12
NMPA发布医疗器械安全和性能基本原则的通告(2020年第18号)
为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了医疗器械安全和性能的基本原则(见附件),现予发布。
阅读更多 -
特事特办:概述医疗器械应急审批程序
2020年1月以来,新型冠状病毒肺炎引发的疫情牵动着所有中国人的心。战“疫”打响,各项工作刻不容缓。英勇的医护工作者正日以继夜奋斗在最前线。同时,医疗器械的生产企业也为了向最前线的医护人员、病患者以及全国人民提供充足的医疗物资而加班加点。

阅读更多 -
2020.03.10
2020年2月CMDE对医疗器械问题的答疑解惑汇总
2月CMDE答疑汇总
阅读更多 -
2020.03.06
欧美澳加口罩出口法规要求概览
随着国内的口罩供应逐步缓解,同时海外的疫情发展加快,口罩产品出口需求已可以清晰预见。为应对近两天广大客户关于口罩出口认证的问询,SUNGO整理相关国家和地区法规要求以及我们可以提供的服务内容。摘要见表1。
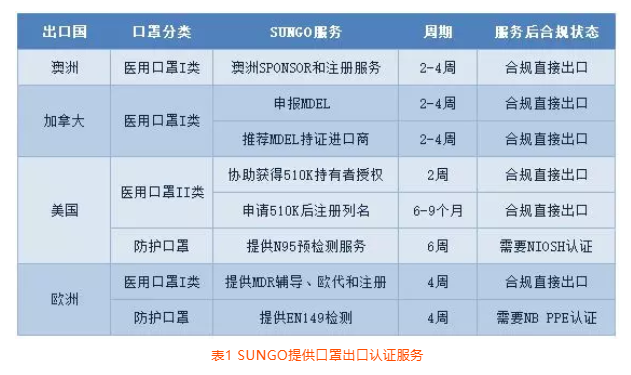
阅读更多 -
2020.03.02
器审中心关于落实《市场监管总局 国家药监局 国家知识产权局支持复工复产十条》有关事宜的通告(2020年第7号)
为深入贯彻落实习近平总书记关于坚决打赢疫情防控阻击战的重要指示精神,按照《市场监管总局 国家药监局 国家知识产权局支持复工复产十条》的工作部署,现就医疗器械注册技术审评有关事宜通告如下:

阅读更多











