【独家】遵循ISO 14971:2019(医疗器械-风险管理对医疗器械的应用)
2021-02-22
 将风险管理和FMEA(潜在失效模式及后果分析)分开,以便推动医疗器械行业发展。
将风险管理和FMEA(潜在失效模式及后果分析)分开,以便推动医疗器械行业发展。
本·希吉特(Ben Higgitt)| 2020年8月7日
FMEA(潜在失效模式和后果分析)用于识别在产品设计或产品制造中潜在的失效模式。但是,医疗器械的相关风险并不仅仅是由失效造成的。一个产品可能永远不会故障,但仍有许多其他潜在风险。
有些产品团队仍然认为FMEA有助于推进风险管理。然而,自从ISO 14971被广泛采用以来,大多数公司都将FMEA作为更大风险管理系统的一个组成部分,但二者往往仍在同一工具/程序中使用。挑战是如何将这些功能分离,以建立最有效的风险管理系统。
ISO 14971:2019, FMEA和风险管理
将FMEA从风险管理过程中分离出来很重要,因为这些活动的目标根本不同。例如:
• FMEA是一种可靠性工具,用于识别、评估和控制医疗器械在设计和制造或装配中可能出现的失效。
• 根据ISO 14971:2019,风险分析的定义是“系统使用现有的信息以识别危害并估计风险”,包括正确和可合理预见的不正确使用/误用。
最终,FMEA应该为有可能造成伤害的失效提供风险分析过程。将FMEA和风险分析合并为一个程序/工具的风险是:
1. 可能会漏掉与医疗器械相关的风险,而这些风险并非由失效造成。
2. 可能会遗漏与风险无关的失效,或者导致 “不必要”的分析,其中危害的定义为 “无危害”。
3. 对“危险情况”最终导致伤害的可能性分析不足;
虽然越来越多的人认为,将这些工具结合起来是错误做法,但如何进行分割,它们之间的联系是什么,这些问题仍有待商榷。
首先,让我们看看IEC 60812:2018中FMEA的定义和ISO/TR 24971:2020中风险分析的定义(ISO 14971应用指南)有何不同。
在FMEA中,有三大要素:
• 原因(导致失效的一系列情况)。
• 失效模式(失效发生的方式)
• 后果(失效的后果)
在风险分析中,有四大要素:
• 危害(潜在危害源)
• 危险情况(人员、财产或环境面临一种或多种危险)。
• 一系列事件(可能导致危险情况的一系列独立事件或组合独立事件);
• 伤害(对人体健康造成伤害或损害,或对财产或环境造成损害)。
将FMEA与风险管理相结合的两种方法
1将“FMEA”等同于“风险分析”。
方法一是将FMEA的组成部分等同于风险分析的组成部分(即,“局部/系统后果”等同于“危害”)。
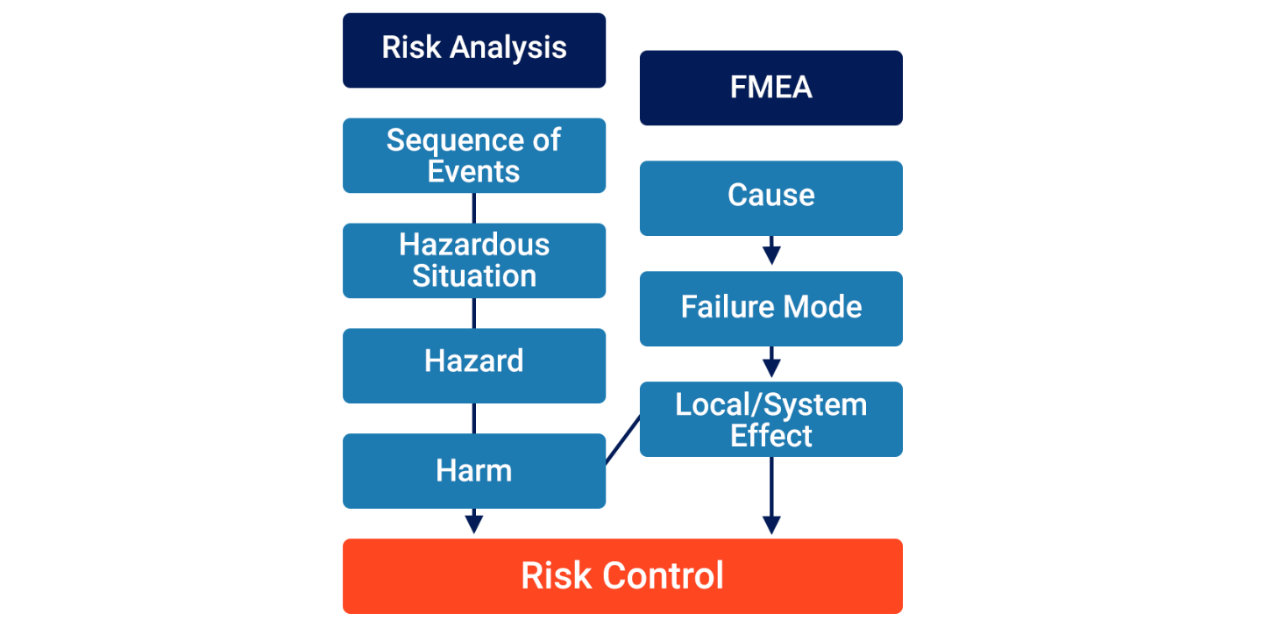
虽然从工具的角度来看这种方法很方便,但它并不符合ISO 14971的要求。只有当一系列的事件发生,导致一种危险情况暴露于一种或多种危险时,医疗器械才会造成伤害。ISO/TR 24971:2020第5.4.3节的指南规定:
“在只是由故障导致的危险情况下,故障发生的概率与伤害发生的概率是不一样的。故障可以引发一系列事件,但不一定会导致危险情况”。
假设所有失效最终都会导致危害,以此将后果等同于危害,这使得风险分析过程过于简化。
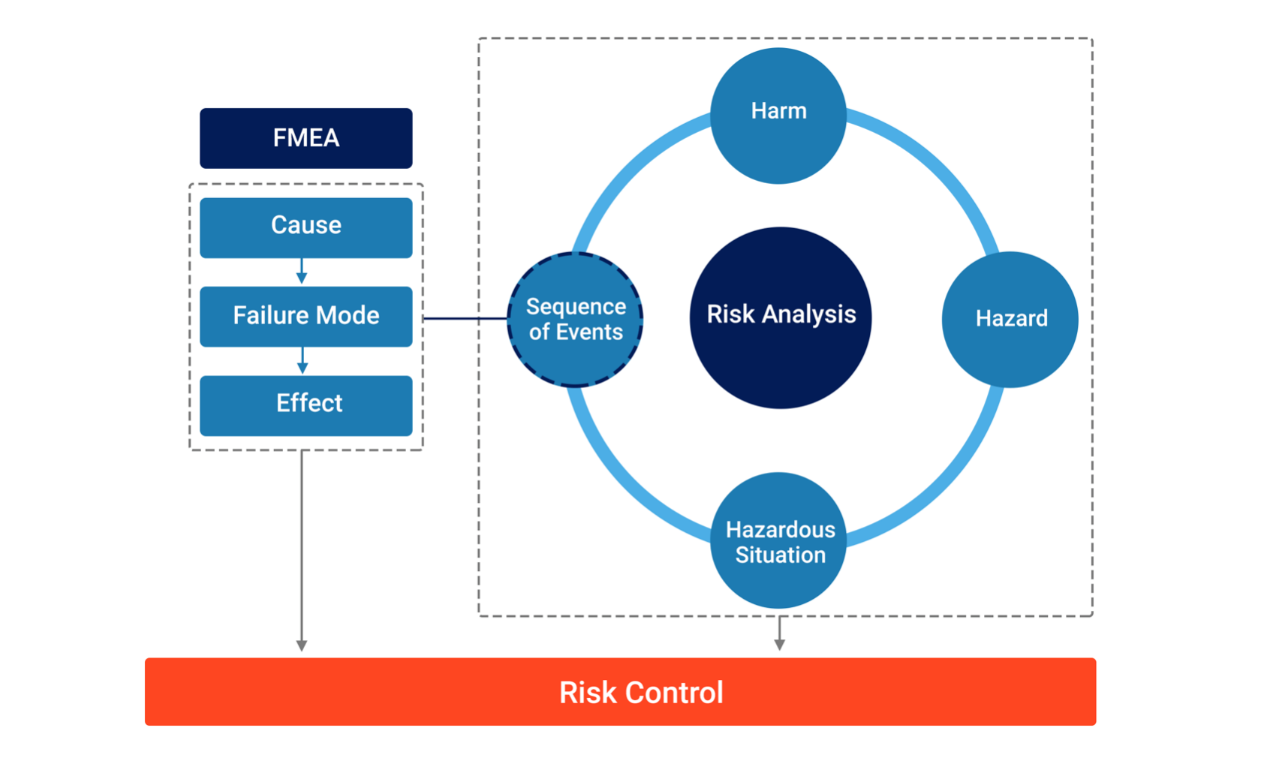
2将 “FMEA”与“风险分析”结合起来
经过广泛的研究,从零开始,我们总结认为FMEA和风险分析之间的联系是通过“系列事件”这一部分产生的。
可进行FMEA,并确定原因(以及相关的可能性)、失效模式和后果。然后可以评估这些后果是否会导致 “危险情况”。
• 如果不会导致危险情况,失效模式、原因和后果仍然是一个需要评估和解决的可靠性问题。
• 如果会导致危险情况,则通过 “系列事件”将失效模式、原因、后果与风险分析联系起来。
这样,我们可以保持FMEA中所做的工作–可能性分析为风险分析中的可能性评估(ISO 14971:2019附录C.1和ISO/TR 24971:2020图1中描述的P1术语,“P1是危险情况发生的概率”)提供了依据。如果FMEA中确定的控制措施能有效降低风险,可在风险分析评估中重复使用这些控制措施。这有助于避免重复工作或避免制定竞争性风险控制策略。
风险管理非常复杂,需考虑很多因素。持续、一致的对话,以及挑战不同的方法,可以帮助我们促进医疗器械行业的发展。我们喜欢谈论风险管理,请加入讨论–你喜欢哪种方法?











